Было изучено много химических реакций. У них есть общие признаки, но и отличительные, так как каждая реакция непохожа на другую.
По числу и составу исходных веществ и продуктов реакции делятся на реакции соединения, разложения, замещения и обмена.
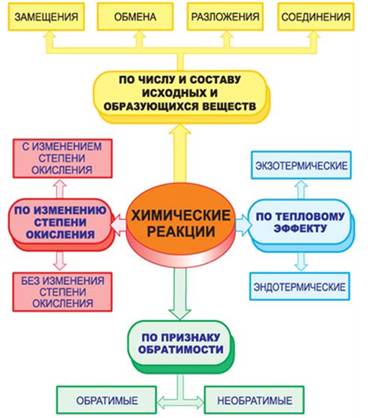
К реакциям соединения относятся реакции, в результате которых из двух или нескольких простых или сложных веществ образуется одно сложное. Например, в реакциях металла или неметалла с кислородом образуются оксиды. В реакции серы с кислородом, образуется оксид серы (II), в реакции фосфора с кислородом – оксид фосфора (V), а в реакции магния с кислородом – оксид магния. Все эти реакции сопровождаются выделением света и тепла. Поэтому их ещё называют реакциями горения.
S + O2 = SO2
4P + 5O2 = 2P2O5
2Mg + O2 = 2MgO
Реакции соединения

Реакцией соединения можно получить и соли, например, когда металл реагирует с неметаллом, так в реакции горения железа в хлоре, образуется соль – хлорид железа (III).

2Fe + 3Cl2 = 2FeCl3
В реакцию соединения могут вступать и два сложных вещества с образованием одного сложного. Например, в реакции сложных веществ оксида кальция с водой образуется сложное вещество гидроксид кальция.

СаО + Н2О = Са(ОН)2
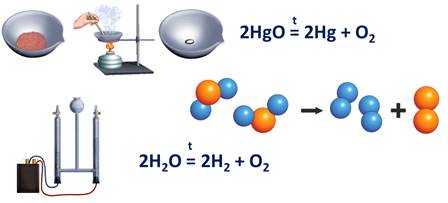
К реакциям разложения относятся реакции, в результате которых из одного сложного вещества образуется два или более новых веществ. Например, реакция разложения оксида ртути (II). В результате этой реакции образуется ртуть и кислород. Или, например, при разложении воды в электролизёре образуется кислород и водород.
2HgO = 2Hg + O2
2Н2О = 2Н2 + О2
Реакции разложения
К реакциям замещения относятся реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе, при этом образуется новое простое и новое сложное вещество. К реакциям замещения относятся реакции взаимодействия металлов с кислотами и металлов с солями. Так, в реакции цинка с серной кислотой образуется новое сложное вещество – сульфат цинка и выделяется газ водород (новое простое вещество).
Zn + H2SO4 = ZnSO4 + H2↑
Или, как в реакции железа с раствором сульфата меди (II) атомы железа замещают атомы меди в сложном веществе и образуется новое сложное вещество – сульфат железа (II) и новое простое – медь.
Fe + CuSO4 = FeSO4 + Cu↓
Реакции замещения

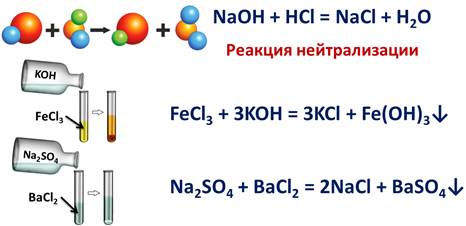
В реакциях обмена обязательно участвуют два сложных вещества, которые обмениваются своими составными частями. Например, реакция между гидроксидом натрия и соляной кислотой. В реакцию ступают два сложных вещества и образуется два новых сложных вещества – хлорид натрия и вода. К тому же, эта реакция ещё является и реакцией нейтрализации, т.к. в реакцию вступает щёлочь и кислота, при этом образуется соль и вода.
NaOH + HCl = NaCl + H2O
К реакциям обмена относятся и реакции между основанием и солью, так если в реакцию вступает хлорид железа (III) и гидроксид калия, то в результате реакции образуется соль – хлорид калия и выпадает осадок – гидроксид железа (III).
FeCl3 + 3KOH = 3KCl + Fe(OH)3↓
Соли могут также вступать друг с другом в реакцию, это также будут реакции обмена, в результате которых образуются две новые соли. Так, в реакции сульфата натрия с хлоридом бария образуется две новые соли – хлорид натрия и сульфат бария.
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
Реакции обмена
По признаку выделения теплоты реакции делятся на экзотермические и эндотермические. Если реакции протекают с выделением теплоты, то такие реакции называются экзотермическими (в переводе с греческого экзо обозначает «наружу»), если реакции протекает с поглощением теплоты, то их называют эндотермическими (эндо означат «внутрь»).
Экзотермические и эндотермические реакции
Количество теплоты, которое выделяется или поглощается в результате реакции, называют тепловым эффектом реакции. Тепловой эффект реакции обозначают латинской буквой Q («ку») и выражают в килоджоулях (кДж). Для экзотермических реакций Q > 0, для эндотермических реакций, наоборот, Q < 0. К экзотермическим реакциям относятся реакции горения серы, магния, фосфора, а реакция разложения ртути является эндотермической.

S + O2 = SO2 + Q
4P + 5O2 = 2P2O5 + Q
2Mg + O2 = 2MgO + Q
2HgO = 2Hg + O2 – Q
По признаку обратимости реакции делятся на обратимые и необратимые. Обратимые реакции всегда протекают одновременно в двух противоположных направлениях, как реакция получения аммиака их двух простых веществ – азота и водорода. В этих реакциях вместо знака равенство ставится знак обратимости.
N2 + 3H2 ↔ 2NH3
Необратимые реакции идут до конца, т.е. в результате этих реакций образуется газ, осадок или слабый электролит. Например, в реакции соляной кислоты и карбоната калия образуется углекислый газ и вода, т.е. реакция прошла до конца.
2HCl + K2CO3 = 2KCl + CO2↑ + H2O
Обратимые и необратимые реакции

По признаку участия катализатора реакции делятся на каталитические и некаталитические. Каталитические реакции – это реакции, протекающие с участием катализатора. Например, реакция получения оксида серы (VI) из оксида серы (IV) является каталитической, т.к. необходимым условием её протекания является наличие катализатора оксида ванадия (V). Катализатор всегда указывается над знаком равенства или обратимости.
V2O5
2SO2 + O2 ↔ 2SO3
По признаку изменения степени окисления реакции делятся на реакции, протекающие без изменения степени окисления и реакции, протекающие с изменением степени окисления, или окислительно-восстановительные. Так, реакция разложения гидроксида меди (II) на оксид меди (II) и воду протекает без изменения степени окисления, а реакция взаимодействия нитрата серебра (I) с медью является окислительно-восстановительной, т.к. медь изменяет степень окисления с 0 до +2, а серебро понижает свою степень окисления с +1 до 0.


 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 21515
21515