Как показали опыты Ньютона, белый свет является сложным: пройдя через призму он разлагается на пучки различных цветов, которые образуют на экране разноцветную полоску, называемую спектром.
Отдельные цветные лучи, которые после прохождения призмы не разлагались на составляющие, были названы простыми или монохроматическими. Однако, как показали опыты не только по дисперсии, но и по дифракции света, даже современные лазеры не дают чистого монохроматического света, то есть света строго определённой, одной длины волны. Та энергия, которую несёт с собой свет от источника теплового излучения, неравномерно распределена по всем частотам волн, входящих в состав светового пучка. Ранее мы с вами показали, что энергия, приходящаяся на все частоты электромагнитной волны (а свет, не забываем, имеет электромагнитную природу) определяется плотностью потока или интенсивностью:

А для характеристики распределения излучения по частотам вводят новую величину, называемую спектральной плотностью потока излучения. Она определяется интенсивностью излучения, приходящегося на единичный интервал частот.

Спектральную плотность потока излучения на разных частотах можно найти экспериментально. Для этого с помощью призмы получают спектр излучения, например флуоресцентной лампы, и измеряют плотность потока излучения, приходящегося на небольшие спектральные интервалы шириной ∆ν.

По результатам таких опытов строят кривую зависимости спектральной плотности интенсивности излучения от частоты, которая даёт наглядное представление о распределении энергии в видимой части спектра исследуемого источника.
Для получения хороших и ярких спектров без перекрывания их отдельных участков, используются специальные оптические приборы, называемые спектральными аппаратами. Их основной частью является призма или дифракционная решётка.
Первый спектральный аппарат — спектроскоп, был изобретён в тысяча восемьсот пятнадцатом (1815) году немецким физиком Йо́зефом Фраунго́фером.

В оригинальном дизайне спектроскопа свет, прошедший через щель, расположенную в фокальной плоскости коллиматорной линзы, преобразовывался в тонкий световой пучок и попадал на призму. Из призмы же выходили параллельные пучки разного направления, которые, преломившись в линзе зрительной трубы, образовывали в её фокальной плоскости изображение щели. Наблюдение велось через трубку со шкалой, накладываемой на спектральное изображение, позволяя таким образом проводить измерения.
С изобретением фотографической плёнки был создан более точный прибор: спектрограф. Работая по такому же принципу, он имел фотокамеру вместо наблюдательной трубки. В середине ХХ века камера сменилась трубкой электронного фотоумножителя, что позволило значительно увеличить точность и проводить анализ в реальном времени.
Как вы смогли убедится, при исследовании света, излучаемого нагретыми телами (Солнца, пламени свечи или лампы накаливания), изображения щели сливаются в одну цветную полосу́ всех основных цветов. Поскольку в таких спектрах нет пустых промежутков, то их принято называть непрерывными или сплошными спектрами.
Помимо раскалённых твёрдых тел и жидкостей, сплошной спектр дают также пары́ и газы, находящиеся под очень большим давлением.
Распределение энергии в сплошном спектре по частотам для разных тел различно. Например, абсолютно чёрное тело излучает электромагнитные волны всех частот, но кривая зависимости спектральной плотности интенсивности излучения от частоты имеет максимум при определённой частоте. При повышении температуры тела максимум спектральной плотности излучения смещается в сторону коротких волн.
В 1853—1854 годах немецкий химик-экспериментатор Роберт Вильгельм Бунзен совместно с Питером Десагой изобрели специальную газовую горелку, которую сейчас принято называть бунзеновской. Это изобретение стало трамплином в изучении спектров различных веществ.

Оказалось, что вещества, внесённые в пламя этой горелки, превращались в пар и окрашивали пламя в различные цвета. Например, медь окрашивала пламя в зелёный цвет, поваренная соль — в жёлтый, а литий — в малиново-красный.
В 1854 году большой друг Бунзена немецкий физик Густав Роберт Кирхгоф предложил пропускать свет такого пламени через призму. Оказалось, что если в пламя горелки внести кусочек асбеста, смоченный, например, раствором обычной поваренной соли, то на бледном фоне сплошного спектра горелки возникнет яркая жёлтая линия, которую дают пары натрия.

Если же в пламя горелки внести литий или стронций, то пламя окрасится в малиново-красный цвет. Однако если изучить спектр такого пламени, то окажется, что он существенно различается для паров лития и стронция. Так, после прохождения через призму свет литиевого пламени даёт яркие зелёную, малиновую и слабую оранжевую линии. А вот стронций — слабую фиолетовую, три голубых линии, две красных и слабую оранжевую.

Характерный спектр, также состоящий из набора отдельных цветных линий, даёт свечение газового разряда в трубке, содержащей исследуемый газ. Например, спектр испускания атомарного водорода представляет собой четыре яркие цветные линии. А при исследовании атомарного гелия мы можем рассмотреть до 12 цветных линий в его видимой части спектра.
Спектры, представляющие собой цветные линии различной яркости, разделённые широкими тёмными полосами, называют линейчатыми спектрами.
Наличие линейчатого спектра означает, что вещество излучает свет только в определённых очень узких спектральных интервалах. На экране вы видите примерное распределение спектральной плотности интенсивности излучения в линейчатом спектре.

Линейчатый спектр часто называют фундаментальным, так как излучения атомов каждого химического элемента имеет уникальный набор спектральных линий: не существует двух химических элементов, атомы которых излучали бы одинаковый спектр. Поэтому для каждого химического элемента составлена специальная таблица, в которой указаны характерные для него линии и их яркость.
Обратим ваше внимание на то, что линейчатые спектры дают все вещества, находящиеся в атомарном (но не молекулярном) состоянии.
Если же газ находится в молекулярном состоянии, то спектр его излучения будет представлять собой отдельные полосы, разделённые тёмными промежутками. Такой спектр называют полосатым.
С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса такого спектра представляет собой совокупность большого числа очень тесно расположенных линий.

Описанные нами выше спектры получались при разложении излучаемого света самосветящимися телами. Такие спектры называют спектрами испускания или эмиссионными спектрами. Но кроме них существуют ещё и спектры поглощения.
Для их наблюдения перед не нагретыми парами изучаемого вещества (у нас это стронций) располагают источник света, дающий непрерывный спектр. На экране, установленном за призмой, можно увидеть сплошной спектр, перерезанный 7 тёмными линиями. Эти линии получили название линий поглощения, а сам спектр — линейчатого спектра поглощения.

В тысяча восемьсот пятьдесят девятом году Роберт Бунзен и Густав Кирхгоф установили, что линии поглощения находятся в тех же участках спектра, где должны быть расположены яркие линии в линейчатом спектре испускания, присущие данному веществу. На основе этих наблюдений Кирхгоф сформулировал закон обратимости спектральных линий: атомы менее нагретых тел поглощают из сплошного спектра только те частоты, которые в других условиях они испускают.
И действительно, мы знаем, что поглощение света веществом зависит от длины волны. Например, зелёный светофильтр пропускает лишь волны, соответствующие зелёному свету, а все остальные поглощает. Тоже самое происходит и с газом. Если пропускать белый свет сквозь холодный, не излучающий газ, то на фоне непрерывного спектра источника появляются тёмные линии, соответствующие длинам волн, которые газ испускает в сильно нагретом состоянии.

Таким образом, анализ линейчатых спектров излучения и поглощения позволяет расшифровать состав излучающего вещества. Метод определения химического состава вещества по его спектру называют спектральным анализом. Основоположниками данного метода, как вы уже, наверное, догадались, являются Роберт Бунзен и Густав Кирхгоф. Открытие спектрального анализа ознаменовало появление нового раздела физики — спектроскопии, изучающей спектры электромагнитного излучения.
Спектральный анализ базируется на двух основных положениях:
· каждый химический элемент или химическое соединение характеризуется определённым спектром;
· интенсивность линий и полос в спектре зависит от концентрации того или иного элемента в веществе.
Спектральный анализ при всей своей простоте, обладает рекордной чувствительностью: с его помощью можно обнаружить примесь нужного элемента в составе сложного вещества даже в том случае, когда его масса не превышает и тысячной доли микрограмма. Так, например, основатели спектрального анализа, исследуя спектры паров щелочных металлов лития, натрия и калия, обнаружили новые элементы — рубидий и цезий, названные так по цвету наиболее ярких линий в их спектрах: рубидий даёт темно-красные, рубиновые линии, а слово «цезий» означает «небесно-голубой».
При выполнении спектрального анализа вещества с неизвестным химическим составом его сначала приводят в атомарное состояние, сообщая атомам большую энергию. Чаще всего для этих целей используются высокотемпературные источники света), в которые помещается исследуемое вещество в виде порошка или аэрозоля. Затем при помощи спектрографа получают фотографию спектров. Сравнивая полученный линейчатый спектр с известными спектрами химических элементов, можно определить, какие элементы присутствуют в составе исследуемого вещества.
Благодаря относительной простоте и достаточной универсальности спектральный анализ является основным методом для контроля состава вещества в машиностроении и металлургии, атомной индустрии. С его помощью определяется химический состав руд и минералов, определяется возраст археологических находок.
Спектральный анализ можно проводить не только со спектрами испускания, но и со спектрами поглощения. Именно линии поглощения в спектрах не только Солнца, но и других звёзд позволяют исследовать химический состав этих небесных тел. Так, например, при изучении спектра солнечной атмосферы 18 августа 1868 года был открыт ранее неизвестный химический элемент, названный гелием (от греческого слова «гелиос» — Солнце). А на Земле этот газ был обнаружен лишь в 1881 году итальянцем Луи́джи Пальмье́ри в вулканических газах фумарол. Однако учёные круги встретили это сообщение с недоверием, так как свой опыт Пальмьери описал неясно. Поэтому считается, что гелий на Земле был открыт лишь спустя 27 лет после своего первоначального открытия шотландским химиком Уильямом Рамзаем.
Спектральный анализ в астрофизике даёт возможность определять не только химический состав звёзд и газопылевых облаков, но и некоторые другие физические характеристики, например, температуру, давление, скорость движения небесного тела и индукцию его магнитного поля. Именно благодаря спектральному анализу было открыто смещение спектральных линий в спектрах галактик в красную (длинноволновую) область спектра, что свидетельствовало о расширении нашей Вселенной. Таким образом, во многих случаях, когда другие методы исследования невозможны, спектральный анализ позволяет получать очень ценные и важные результаты.

 Получите свидетельство
Получите свидетельство Вход
Вход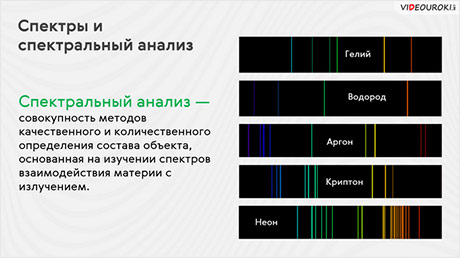




 10553
10553



