Недавно мы говорили о размерах молекул и выяснили, что они очень малы. Как вы понимаете, измерять массу молекул в обычных единицах массы, таких как килограммы или граммы, крайне неудобно. Поэтому люди придумали относительную молекулярную массу. Относительная молекулярная (или атомная) масса вещества — это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Дело в том, что углерод входит в множество веществ, и по международному соглашению было решено использовать углеродную шкалу атомных масс. Нетрудно догадаться, что относительная молекулярная масса — это безразмерная величина, поскольку она показывает во сколько раз масса данной молекулы (или атома) больше массы одной двенадцатой атома углерода. Тем не менее, молекулярную массу условились измерять в атомных единицах массы (а. е. м.).
Относительные массы всех химических элементов измерены с высокой точностью, и их можно найти в таблице Менделеева.

Например, относительная атомная масса водорода равна 1, относительная атомная масса гелия равна 4 и так далее.
Зная
атомные массы можно вычислить и молекулярную массу. Например, относительная
молекулярная масса соляной кислоты равна 
Аналогичным
способом можно вычислить массы других молекул. Например, молекула серной кислоты
состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Таким образом, относительная молекулярная масса серной кислоты равна  .
.
Еще
одно понятие, с которым необходимо ознакомиться при изучении
молекулярно-кинетической теории — это количество вещества. Можно,
конечно, определить количество вещества, как количество молекул, содержащихся в
данном теле. Но, как мы уже убедились, это количество просто огромно для любого
макроскопического тела, поэтому нам снова нужно ввести специальную величину.
Эта величина так и называется «количество вещества» и обозначается буквой ν.
Единицей измерения количества вещества является моль:  .
.
1 моль — это количество вещества, в котором содержится столько же молекул или атомов, сколько содержится атомов в 12 г углерода.
Это число было определено Амедео Авогадро еще в 19 веке. Один моль любого вещества содержит 6,02 х 1023 молекул. Это число называется числом Авогадро или постоянной Авогадро.
Таким образом, зная число молекул в теле, можно определить количество вещества:

С постоянной Авогадро связана и другая величина, которая называется молярной массой — это масса данного вещества, взятого в количестве 1 моль.
Исходя
из этого, можно заключить, что молярная масса вещества равна  .
.
Как
видно из этого уравнения, молярная масса измеряется  .
Заметим, что массу любого вещества можно представить, как произведение массы
молекулы этого вещества и количества молекул, содержащегося в данном веществе:
.
Заметим, что массу любого вещества можно представить, как произведение массы
молекулы этого вещества и количества молекул, содержащегося в данном веществе: 
Тогда можно записать:

Необходимо отметить, что молярную массу можно также взять из таблицы Менделеева, как и молекулярную массу. Они численно равны, но следует понимать, что они обозначают различные величины, а потому измеряются в различных единицах измерения. В таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать переводить её в кг/моль при решении задач по физике.
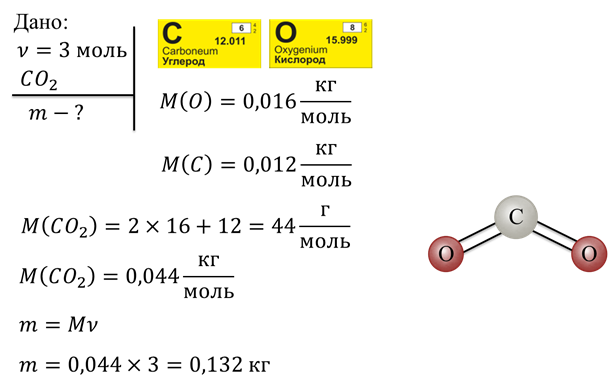
Пример решения задачи.
Задача 1. Определите массу 3 моль углекислого газа.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 12751
12751

