В органической химии есть вещества, содержащие не только атомы кислорода, как спирты, альдегиды и карбоновые кислоты, но и соединения, в состав которых входят атомы азота. Их так и называют азотсодержащие органические соединения.
К азотсодержащим органическим соединениям относятся: нитросоединения, содержащие нитрогруппу, связанную с углеводородным радикалом. К азотсодержащим органическим соединениям относятся также амины, аминокислоты и белки.
Большой вклад в изучение и получение азотосодержащих органических соединений внесли русские учёные А. Я. Данилевский и Н. Н. Зинин.

Амины можно представить как производные аммиака, в молекулах которого один или несколько атомов водорода заменены на углеводородные радикалы.
В зависимости от числа углеводородных групп, замещающих атомы водорода в молекуле аммиака, различают первичные, вторичные и третичные амины.
В зависимости от природы углеводородных заместителей амины делятся на: алифатические, например метиламин, алициклические, как циклогексиламин и ароматические, как фениламин, или анилин.

В состав первичных аминов входит группа – NH2, которую называют аминогруппой. Поэтому общая формула первичных аминов R – NH2, или CnH2n+1NH2, где CnH2n+1 – алкильная группа.
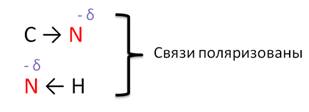
В молекулах аминов связи C – N и N – H поляризованы, потому что атом азота является более электроотрицательным, чем атомы углерода и водорода, но полярность связи в аминах выражена меньше, чем в спиртах, поэтому и реакции замещения менее характерны.
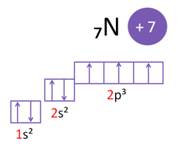
Свойства аминов также обусловлены особенностями строения атома азота. Так, в атоме азота на внешнем энергетическом уровне три неспаренных электрона, которые могут образовывать связи с другими атомами. А одна пара электронов у атома азота остаётся неподелённой.
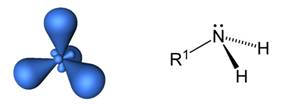
Атом азота в аминах имеет тетраэдрическую ориентацию орбиталей, а сама молекула – тригонально-пирамидальную структуру.
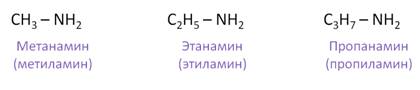
Названия первичных аминов по заместительной номенклатуре состоит из названия исходных углеводородов с добавлением слова «амин». Назовём первичные амины. Первый амин называется метанамин, или метиламин, второй – этанамин, или этиламин, третий амин называется пропанамин, или пропиламин.
Вторичные амины по номенклатуре ИЮПАК называют следующим образом: указывают наличие атома азота символом N и после дефиса перечисляют младшую, потом старшую углеводородные группы, добавляя в конце слово «амин». Назовём вторичные амины.

Для аминов характерна структурная изомерия, которая обусловлена изомерией углеродного скелета (изомерия цепи) и изомерия положения аминогруппы.
Составим всевозможные изомеры к амину состава C5H11NH2. Изомерия углеродной цепи будет представлена изомерами: пентанамином-1, 2-метилбутанамином-1 и 2, 2-диметилпропанамином-1.
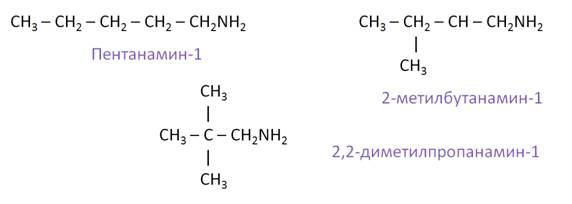
Изомерия положения аминогруппы представлена такими изомерами, как: пентанамин-1, пентанамин-2, пентанамин-3.
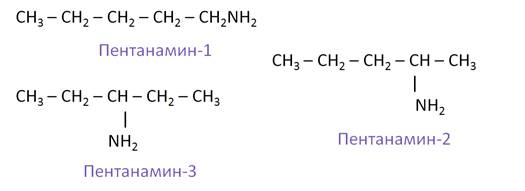
Первичные, вторичные и третичные амины, у которых одинаковое число атомов углерода, изомерны между собой. Так, изомерами между собой являются этиламин и диметиламин.
CH3 – CH2 – NH2
(CH3)2NH
Метиламин, диметиламин и триметиламин – газообразные вещества, с запахом аммиака, хорошо растворяются в воде, так как их молекулы образуют водородные связи с молекулами воды. Средние члены алифатического ряда – жидкости со слабым запахом тухлой рыбы, с постепенно повышающейся температурой кипения. Высшие амины – твёрдые нерастворимые вещества, не имеющие запаха.
Связь N – H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О – Н).
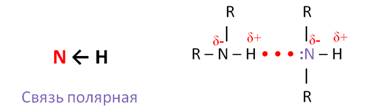
Это объясняет относительно высокую температуру кипения аминов по сравнению с алканами со схожей молекулярной массой. Амины кипят при более низкой температуре, чем спирты со схожей молекулярной массой, так как межмолекулярные водородные связи в них менее прочные из-за меньшей электроотрицательности азота.
Амины широко распространены в природе. Например, многие биологически активные вещества относятся к аминам.
Триметиламин впервые был выделен в середине 19 века из продуктов перегонки селёдочного рассола, поэтому он и получил название «рыбный газ» и имел специфический запах рыбы. Триметиламин получилось выделить и из слёз человека, желудочного сока, поджелудочной железы.
Химические свойства аминов обусловлены наличием аминогруппы, а в частности наличием неподелённой пары электронов у атома азота. Эта непроделённая пара электронов может образовывать химическую связь по донорно-акцепторному механизму. Поэтому амины – это органические основания.

Например, при растворении метиламина в воде образуется щелочной раствор и ион метиламмония.
CH3NH2 + HOH ↔ CH3NH3+ + OH-
Амины реагируют с неорганическими кислотами с образованием аммониевых солей. Так, в реакции метиламина с соляной кислотой образуется соль – хлорид метиламмония, в реакции этиламина с серной кислотой образуется соль – гидросульфат этиламмония.
CH3 – NH2 + HCl → CH3 – NH3Cl
C2H5 – NH2 + H2SO4 → C2H5NH3HSO4
Если на полученную соль подействовать более сильным основанием, то образуется исходный амин. Так, при действии на соль – гидросульфат этиламмония гидроксидом натрия образуется этиламин.
C2H5NH3HSO4 + NaOH → C2H5NH2 + NaHSO4 + H2O
Для аминов, как и других органических соединений, характерны реакции горения. Так, при горении метиламина образуется оксид углерода (IV), вода и азот.
4CH3NH2 + 9O2 → 4CO2↑ + 10H2O + 2N2↑
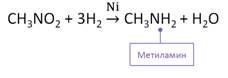
В лаборатории первичные амины получают восстановлением нитросоединений. Так, при восстановлении нитрометана водородом в присутствии никелевого катализатора образуется метиламин и вода.
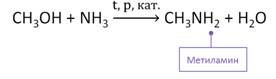
В промышленности амины получают в реакции спирта и аммиака под давлением. Так, в реакции метанола с аммиаком в присутствии катализатора – оксида алюминия, образуется метиламин.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза, для получения взрывчатых веществ. Гексаметилендиамин при поликонденсации с адипиновой кислотой даёт полиамидные волокна. Многие амины и их производные применяют в косметической, пищевой, нефтехимической промышленности.
Таким образом, аминами называются производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Функциональной группой аминов является NH2 – группа – аминогруппа. Для аминов характерна структурная изомерия: изомерия углеродной цепи и положения аминогруппы. Амины проявляют основные свойства в реакциях с неорганическими и органическими кислотами. Получают амины из нитросоединений и спиртов. Амины находят широкое применение в производстве красителей, лекарственных и взрывчатых веществ.

 Получите свидетельство
Получите свидетельство Вход
Вход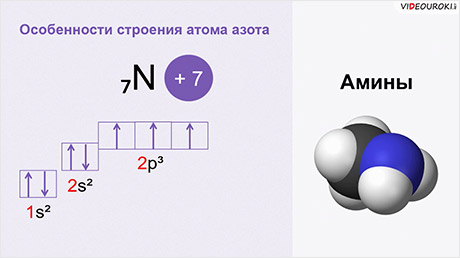



 1
1 10586
10586


Просто, доходчиво, наглядно