Кремний и его соединения. Силикатная промышленность
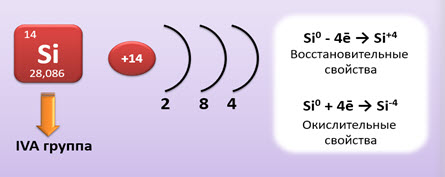
Кремний – элемент IV A группы, как и углерод. Поэтому на внешнем энергетическом уровне у него четыре электрона. Эти четыре электрона он может отдавать и проявлять восстановительные свойства, при этом его степень окисления будет равна +4, а может присоединять четыре электрона и проявлять окислительные свойства, при этом степень окисления у него будет -4.
В природе кремний – второй по рапространённости после кислорода химический элемент. В природе он встречается только в виде соединений. Наиболее распространёнными соединениями кремния является оксид кремния (IV) – SiO2 – кремнезём. В природе он образует минерал кварц. Его разновидностью является горный хрусталь, аметист, агат, топаз, опал, яшма, халцедон, сердолик, которые используют как поделочные и полудрагоценные камни.

Природные силикаты – сложные вещества. Их состав изображают в виде нескольких оксидов. Силикаты, в состав которых входит алюминий, называют алюмосиликатами. Это каолинит, полевой шпат, слюда.

Асбест тоже является силикатом и используется для изготовления огнеупорных тканей.

Из разновидностей минералов на основе оксида кремния (IV) первобытные люди изготавливали орудия труда. Кремний положил начало каменному веку, то есть веку кремнёвых орудий труда из-за его доступности и способности образовывать острые режущие края.


Оксид кремния (IV) придаёт прочность стеблям растений и защитным покровам животных.
Благодаря этому оксиду тростники, камыши, хвощи стоят крепко, а листья осоки режут, стебли злаков не ложатся от дождя и ветра, а чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны.

Кремний входит в состав диатомовых водорослей и радиолярий.


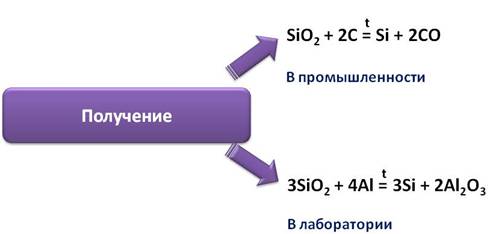
В промышленности кремний получают восстановлением оксида кремния (IV) коксом в электропечах.
В лаборатории его получают восстановлением оксида кремния (IV) алюминием или магнием.
Кремний существует в виде двух аллотропных модификаций: аморфной и кристаллической.
Аморфный кремний представляет собой бурый порошок.

Кристаллический кремний – твёрдое вещество тёмно-серого цвета с металлическим блеском. Он хрупок и тугоплавок. Это обусловлено строением его кристаллов. Структура кремния аналогична структуре алмаза, то есть в этом кристалле каждый атом окружён четырьмя другими атомами и связан с ними ковалентными связями.

Кремний является полупроводником. С повышением температуры его электропроводность увеличивается. Например, на спутниках, космических кораблях, станциях и крышах домов устанавливаются солнечные батареи. Эти батареи, превращают солнечную энергию в электрическую, за счёт кристаллов полупроводников, таких как кремний.

При комнатной температуре кремний инертен, но при нагревании он реагирует с металлами и неметаллами.
Кремний горит в кислороде с образованием оксида кремния (IV).
В этой реакции кремний повышает свою степень окисления с 0 до +4, а кислород понижает с 0 до -2. Поэтому кремний выступает в роли восстановителя, а кислород – в роли окислителя.

Восстановительные свойства кремния используют в металлургии для получения некоторых металлов из их оксидов.

Кремний при нагревании реагирует с металлами, при этом образуются соединения, которые называются силициды. Например, в реакции магния с кремнием образуется силицид магния. В этой реакции магний повышает свою степень окисления с 0 до +2, а кремний понижает с 0 до -4. Поэтому магний – восстановитель, а кремний – окислитель.

Силициды легко разлагаются водой или кислотами, при этом образуется газ силан – водородное соединение кремния. Так, при взаимодействии силицида магния с соляной кислотой образуется хлорид магния и газ силан.

Силан на воздухе самовоспламеняется и сгорает с образованием оксида кремния (IV) и воды.
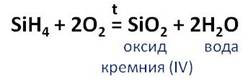
Кремний вступает во взаимодействие с концентрированными растворами щелочей. Например, при взаимодействии кремния с концентрированным раствором гидроксида натрия образуется силикат натрия и водород.
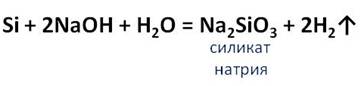
Кремний можно получить нагреванием оксида кремния (IV) с магнием или углеродом.
В реакции с магнием магний восстанавливает кремний из оксида кремния (IV), а в реакции оксида кремния (IV) с углеродом, углерод воссстанавливает кремний из его оксида.

Оксид кремния (IV), кремнезём – SiO2 – твёрдое, очень тугоплавкое вещество, нерастворимое в воде. Этот оксид имеет атомную кристаллическую решётку, в узлах которой находятся атомы кремния и кислорода.

Оксид кремния (IV) является кислотным оксидом, поэтому проявляет все свойства, характерные для этих оксидов. Однако этот оксид не растворяется в воде, но он реагирует с растворами щелочей. Так, в реакции оксида кремния (IV) с гидросидом натрия образуется силикат натрия и вода.


Оксид кремния (IV) вступает в реакции с основными оксидами при нагревании. Так, в реакции с оксидом кальция образуется силикат кальция.

Оксид кремния (IV) взаимодействует при нагревании с карбонатами, так в реакции с карбонатом натрия образуется силикат натрия и углекислый газ.
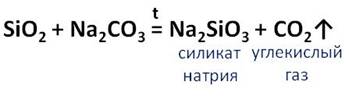
Силикаты натрия и калия называются растворимыми стёклами. Их водные растворы представляют собой силикатный клей.

Оксид кремния (IV) реагирует с фтороводородом и плавиковой кислотой с образованием газообразного фторида кремния.
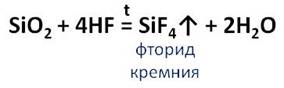
Этим свойством пользуются для вытравливания на стекле надписей, рисунков и меток.
Состав кремниевой кислоты можно выразить как H2SiO3. Кремниевая кислота – студенистое, нерастворимое в воде вещество. Она относится к очень слабым кислотам (даже слабее угольной). При высыхании раствора, содержащем кремниевую кислоту, образуется силикагель, который применяют в качестве адсорбента.
Кремниевая кислота – непрочное соединение и при хранении или при нагревании разлагается на оксид кремния (IV) и воду.

Качественной реакцией на силикат-ион является реакции силикатов с растворами сильных кислот, при этом образуется кремниевая кислота в виде студенистого осадка. Например, в реакции силиката натрия с соляной кислотой образуется соль – хлорид натрия и кремниевая кислота в виде студенистого осадка.

Проведём эксперимент. Для этого пропустим углекислый газ через раствор силиката натрия. При этом мы можем наблюдать образование студенистого осадка. Это образовалась кремниевая кислота. Таким образом, кремниевая кислота очень слабая, даже слабее угольной, которая может вытеснить её из раствора соли.

А теперь к этому студенистому осадку прильём концентрированный раствор щёлочи и нагреем на пламени спиртовки. Осадок начинает растворяться в следствие образования растворимой соли – силиката натрия.


Кремний применяют для получения полупроводниковых материалов и кислотоупорных сплавов. Такое соединение кремния, как карбид кремния – SiC – используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней, потому что по твёрдости он уступает только алмазу.
Из кварца изготавливают кварцевую химическую посуду, которая выдерживает высокую температуру и резкие перепады температур.
Растворимые в воде силикаты натрия и калия («растворимые стёкла») применяют как огнеупорное средство для пропитки древесины и тканей. Для изготовления несгораемых и электроизоляционных текстильных изделий используются также природные силикаты – асбесты.

К силикатной промышленности относят производство:
· Стекла;
· Керамических изделий (фарфора, фаянса гончарных изделий), кирпича, облицовочных плит и кровельных материалов;
· Цемента.



Соединения кремния являются основой для производства стекла и цемента. Например, обычное оконное стекло получают сплавлением смеси соды, известняка и песка. Стекло обладает способностью размягчаться и в расплавленном состоянии принимать различную форму, поэтому его используют для производства посуды.

Определённые свойства стеклу придают добавки. Например, если заменить оксид натрия на оксид калия, то можно получить твёрдое богемское сткело, при добавлении оксида свинца (II) можно получить хрустальное стекло, при добавлении оксида хрома (III) можно получить зелёное стекло, при добавлении оксида кобальта – синее, а при добавлении оксида марганца (II) – фиолетовое. Добавляя соли золота и селена, получают рубиновые стёкла, из которого изготовлены звёзды Московского Кремля.


Для улучшения механических свойств стекло подвергают закалке. Закалка заключается в том, что стекло особого состава нагревают до температуры около 600 0C, а затем резко охлаждают. Такая закалка позволяет получать пуленепробиваемое стекло.


Стекло человеку известно давно, уже три – четыре тыс. лет назад производство стекла было в Египте, Сирии, Финикии, Причерноморье.

Стекло удивительный материал. В Древнем Риме мастера научились получать цветные стёкла и делать из их кусочков мозаики. Из стекла сделаны витражи церквей, музеев, различные мозаичные панно.



Области применения стекла обширны: это оконное, бутылочное, ламповое, зеркальное и оптическое.

Основным сырьём в производстве керамических изделий является глина. При смешивании глины с водой образуется тестообразная масса, способная после сушки и обжига сохранять приданную ей форму. Некоторые керамические изделия покрывают глазурью – тонким слоем стекловидного материала. Глазурь делает керамику водонепроницаемой, предохраняет её от загрязнений, защищает от действия кислот и щелочей, придаёт блеск.


Немаловажным соединением кремния является цемент. Его получают спеканием глины и известняка. Если смешать порошок цемента с водой, то образуется так называемый «цементный раствор», который потом постепенно затвердевает. Если добавить к цементу песка или щебня, то получится бетон. Прочность бетона можно увеличить, если ввести железный каркас, тогда получается железобетон, из которого изготавливают стеновые панели, блоки перекрытий.



Кремний был получен в 1824 году шведским химиком Берцэлиусом. Но за двенадцать лет до него кремний получил Гей-Люссак и Тэнар, но он был очень загрязнён примесями.



Латинское название силициум от латинского силекс – «кремень». Русское название «кремний» происходит от греческого кремнос – «утёс, скала».
Таким образом, кремний – элемент IV A группы. Для него характерны степени окисления +4 и -4. В реакциях с кислородом и другими неметаллами он проявляет восстановительные свойства, а в реакциях с металлами – окислительные. В природе кремний встречается в виде соединений. Наиболее распространённое его соединение – оксид кремния (IV) – кремнезём, который является кислотным оксидом и проявляет свойства, характерные для этих оксидов. Водородным соединением кремния является силан – SiH4, который образуется при действии кислот или воды на силициды – соединения металлов с кремнием. Оксиду кремния (IV) соответствует кремниевая кислота. Эта слабая двухосновная, студенистая, нерастворимая в воде кислота. Качественной реакцией на силикат-ион является действие сильных кислот на силикаты, так как в результате этих реакций образуется студенистый осадок – кремниевая кислота. Оксид кремния (IV) и силикаты находят широкое применение в промышленности. К силикатной промышленности относят производство стекла и цемента, керамических изделий и кирпича.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 23671
23671

