Насыщенные одноатомные спирты – это производные алканов, в молекулах которых один атом водорода замещён на гидроксильную группу.
Общая формула насыщенных одноатомных спиртов CnH2n+1OH. В общем виде формула однотомных спиртов R – OH, где R – алкильная группа. Кроме этого, можно использовать формулу, которая отражает молекулярный состав насыщенных одноатомных спиртов – это CnH2n+2O. Если в общую формулу спиртов подставить значения относительных атомных масс, то относительная молекулярная масса спиртов будет
14n + 18.
У спиртов появляется функциональная группа – гидроксильная группа. Атом кислорода в составе функциональной группы обладает высокой электроотрицательностью, поэтому атом он оттягивает на себя электронную плотность от связанных с ним атомов и получает частичный отрицательный заряд. Атом водорода и соседний от кислорода атом углерода приобретают частичные положительные заряды.

При этом связи О – Н и С – O являются полярными.
По правилам номенклатуры ИЮПАК названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов с добавлением суффикса -ол. Главная цепь должна содержать группу ОН, быть самой длинной и содержать наибольшее число заместителей. Нумерацию атомов в главной цепи проводят с того конца, ближе к которому расположена гидроксильная группа. Заместители перечисляются в алфавитном порядке, в конце названия указывается атом углерода, с которым связана группа ОН.
Так, первый представитель спиртов CH3OH называется метанол, или метиловый спирт, второй представитель имеет формулу С2Н5OH – этанол, или этиловый спирт, третий – СН3СН2СН2OH – пропанол-1, или пропиловый спирт, четвёртый представитель гомологического ряда одноатомных спиртов СН3(СН2)2СН2OH называется бутанол-1, или бутиловый спирт, пятый член этого класса соединений СН3(СН2)3СН2OH называется пентанол-1, или амиловый спирт.
Назовём спирт.
Нумерацию спирта начинаем справа, потому что с этой стороны ближе расположена гидроксильная группа, от второго атома углерода отходит заместитель «этил», а от пятого атома углерода – заместитель «метил». Поэтому полное название данного спирта будет 5-метил-2-этилгексанол-1.

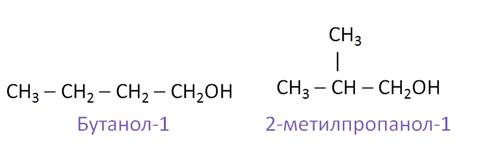
Для насыщенных однотомных спиртов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения гидроксильной группы, а также межклассовая изомерия с простыми эфирами. Для метанола и этанола изомеры отсутствуют. Рассмотрим изомерию спиртов на примере вещества с формулой С4Н10О.
В зависимости от строения углеродного скелета изомерами будут бутанол-1 и 2-метилпропанол-1.
В зависимости от положения гидроксильной группы возможны ещё два изомера для вещества состава С4Н10О. Это бутанол-2 и 2-метилпропанол-2.

Межклассовым изомером к веществу состава С4Н10О будет диэтиловый эфир: С2Н5 – О – С2Н5.
Первые представители класса одноатомных спиртов – жидкости. Начиная со спирта, содержащего 12 и более атомов углерода – это твёрдые вещества. Газы среди спиртов отсутствуют. Низшие спирты обладают характерным алкогольным запахом, спирты, стоящие в середине гомологического ряда, имеют сильный и неприятный запах, высшие спирты, как правило, не имеют запаха.
Спирты, содержащие от одного до трёх атомов углерода, смешиваются с водой в любых соотношениях, средние спирты ограничено растворимы в воде.
С увеличением относительной молекулярной массы растворимость спиртов в воде уменьшается. Большинство спиртов растворимы в органических растворителях.
Спирты имеют более высокие температуры кипения по сравнению с алканами со схожей относительной молекулярной массой. Высокие температуры кипения и отсутствие газов среди спиртов можно объяснить наличием межмолекулярных водородных связей. Из-за наличия у одной молекулы спирта частичного положительного заряда на атоме водорода, а на другой молекуле неподелённой пары электронов на атоме кислорода, образуются межмолекулярные водородные связи.
Химические свойства спиртов обусловлены также наличием в составе гидроксильных групп. Спирты – амфотерные соединения, которые являются слабыми кислотами и очень слабыми основаниями.
Спирты реагируют с активными металлами с образованием алкоголятов и водорода. Так, в реакции этанола с натрием образуется этанолят натрия и водород. Данная реакция относится к реакциям замещения, при этом происходит замещение атомов водорода на атомы металла.

Алкоголята легко разлагаются водой. При взаимодействии этанолята натрия с водой образуется этанол и гидроксид натрия.

Спирты реагируют с карбоновыми и кислородсодержащими минеральными кислотами. В реакции спиртов с карбоновыми кислотами от молекулы спирта отщепляется атом водорода, а от молекулы карбоновой кислоты – гидроксильная группа. Так, в реакции этанола с уксусной кислотой образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты. Данные реакции являются обратимыми и протекают в присутствии концентрированной серной кислоты при нагревании. Реакции спиртов с карбоновыми кислотами называются реакциями этерификации.

В реакциях спиртов с кислородсодержащими минеральными кислотами образуются сложные эфиры этих кислот. Так, в реакции этанола с серной кислотой образуется этилгидросульфат:
CH3 – CH2OH + H2SO4 ↔ C2H5 – O – SO3H + H2O.
Для спиртов характерно взаимодействие с галогеноводородами с образованием галогеналканов. В этих реакциях в спиртах разрывается связь между углеводородным радикалом и гидроксильной группой. Например, в реакции этанола с бромоводородом образуется бромэтан и вода. Эта реакция является также обратимой. В этой реакции проявляются слабые основные свойства спирта:
C2H5OH + HBr ↔ C2H5Br + H2O.
Для спиртов характерна дегидратация под действием концентрированной серной кислоты при нагревании свыше 140 0С, при этом образуются алкены. Так, в результате дегидратации этанола образуется этен.

Если реакция идёт при температуре меньше 140 0С, то образуются простые эфиры. Так, в реакции межмолекулярной дегидратации этанола образуется диэтиловый эфир:
2CH3 – CH2OH → C2H5 – O – C2H5 + H2O.
Для спиртов характерны реакции окисления. Спирты горят на воздухе или в кислороде не коптящим пламенем с выделение большого количества теплоты. При горении этанола образуется оксид углерода (IV) и вода.

Под действием более слабых окислителей происходит частичное окисление спиртов. Если в пробирку с этанолом опустить спираль, покрытую чёрным налётом оксида меди (II), то чёрный налёт на проволоке исчезнет и в пробирке почувствуется запах образовавшегося альдегида. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид:
CH3 – CH2OH + CuO → CH3 – CHO + Cu + H2O.
Вторичные спирты под действием окислителей образуют кетоны, третичные спирты устойчивы к действию окислителей. Так, при окислении пропанола-2 оксидом меди (II) образуется кетон – ацетон:
CH3 – CHOH – CH3 + CuO → CH3 – C(O) – CH3 + Cu + H2O.
Рассмотрим основные способы получения спиртов. Одним из наиболее важных способов получения спиртов является гидратация алкенов. Например, этанол получают гидратацией этилена при повышенной температуре, повышенном давлении и в присутствии катализатора. Полученный таким образом этанол называют синтетическим.

В пищевой промышленности этанол получают при спиртовом брожении глюкозы под действием ферментов. Полученный таким образом этанол используют для изготовления спиртных напитков.

В промышленности метанол получают из синтез-газа в присутствии катализатора.

Спирты можно получить и при гидролизе моногалогеналканов с водными растворами щелочей. Так, при взаимодействии хлорэтана с водным раствором гидроксида калия образуется этанол и хлорид калия:
CH3 – CH2Cl + KOH → CH3 – CH2OH + KCl.
Спирты можно получить восстановлением альдегидов или кетонов. Например, при восстановлении уксусного альдегида образуется спирт этанол, при восстановлении ацетона образуется вторичный спирт – пропанол-2:
CH3 – CHO + H2 → CH3 – CH2OH
CH3 – CO – CH3 + H2 → CH3 – CH(OH) – CH3.

 Получите свидетельство
Получите свидетельство Вход
Вход




 905
905

