На прошлых занятиях мы с вами говорили о том, что при теплопередаче изменяется внутренняя энергия тела. И чаще всего это связано с изменением его температуры. Но при этом агрегатное состояние вещества остаётся прежним. Однако существуют процессы, при которых внутренняя энергия вещества при получении теплоты увеличивается, а температура остаётся постоянной. К таким процессам относятся плавление и кристаллизация (отвердевание).
Вспомним, что это за процессы. Для этого возьмём какой-нибудь стакан, внутрь которого положим немного измельчённого льда, температура которого составляет –12 С. Вставим в стакан термометр и начнём нагревать на плитке. При этом будем следить за изменением температуры льда и процессами, которые с ним происходят.

Как видим, некоторое время лёд остаётся в твёрдом состоянии, хотя его температура постепенно повышается. Как только температура достигает 0 °С, лёд начинает превращаться в воду, то есть плавится. Но, обратите внимание, температура смеси воды и льда остаётся неизменной — ноль градусов.
На что же уходит получаемая льдом теплота? Правильно, на увеличение внутренней энергии вещества. Это увеличение связано с изменением потенциальной энергии взаимодействия частиц при разрушении кристалла. Кинетическая же энергия не изменяется, так как температура остаётся постоянной. И она не меняется, пока весь лёд не перейдёт в жидкое состояние. И только после этого температура образовавшейся изо льда воды начинает повышаться.
Таким образом, мы с вами наблюдали переход льда из твёрдого состояния в жидкое. Такой переход вещества называют плавлением.
Процесс плавления любых кристаллических тел протекает аналогично рассмотренному процессу плавления льда. То есть, чтобы расплавить твёрдое кристаллическое тело, необходимо нагреть его до температуры плавления и в дальнейшем сообщать ему энергию до тех пор, пока всё оно не превратится в жидкость. Исключение составляют те вещества, которые меняют свой химический состав или сразу превращаются в газ.
Температура, при которой вещество переходит из твёрдого состояния в жидкое, то есть плавится, называется температурой плавления.
Конечно же температура плавления у разных кристаллических веществ неодинакова.

Из таблицы видно, что самую низкую температуру плавления (при нормальном атмосферном давлении) имеет химический элемент водород. Его температура плавления равна –259,2 °С. А самую высокую (рекордную) температуру плавления имеет такое химическое соединение, как карбонитрид гафния — около 4200 °С.
Температуру плавления приходится учитывать при создании бытовой и промышленной техники. Так, например, спирали обычных лампочек и нагревательных элементов делают из тугоплавких материалов. А в самолётостроении, в ракетной и космической промышленности используют материалы с очень высокой температурой плавления.
Температуру плавления некоторых веществ можно изменить, смешивая их с другими веществами. Например, если добавить поваренную соль в лёд, то можно получить смесь с температурой плавления −21 °C. Это свойство активно используют дорожные службы, посыпая зимой улицы песчано-соляной смесью.
Но вернёмся к нашему опыту. Давайте поместим стакан вместе с находящейся в нём водой в морозильную камеру и проследим за изменением температуры.

Легко заметить, что сначала вода охлаждается до нуля градусов, отдавая при этом некоторое количество теплоты окружающему воздуху. Причём это количество теплоты равно тому количеству теплоты, которое вода поглощала, нагреваясь до конечной температуры. А вот когда температура воды станет равной нулю, она начнёт превращаться обратно в лёд. И, как и в прошлом случае, температура смеси не будет изменяться до тех пор, пока вся вода не перейдёт в кристаллическое состояние.
Процесс перехода вещества из жидкого состояния в твёрдое называют кристаллизацией или отвердеванием.
А температура, при которой тело кристаллизуется, называется температурой кристаллизации. И эта температура остаётся неизменной во время всего процесса кристаллизации.
Как вы могли заметить из опыта, для кристаллических тел температура кристаллизации равна температуре плавления. Например, если свинец плавится при температуре 327 °C, то и отвердевать оно будет при этой же температуре.
Процессы плавления и кристаллизации довольно-таки сложны. Поэтому полезно уметь изображать данные процессы на графике. На нём отображают все этапы перехода вещества из одного агрегатного состояния в другое. Итак, на экране вы видите такой график для нашего опыта. На нём по оси абсцисс отложено время, а по оси ось ординат — температура вещества, в качестве которого у нас выступает лёд, находящийся в момент начала наблюдения при отрицательной температуре. Обратите внимание на то, что начало оси времени совпадает с температурой плавления вещества. Это сделано для удобства построения подобных графиков.

Итак, какую же информацию мы можем извлечь? Во-первых, из графика видно, что в момент начала наблюдения за процессом температура льда равнялась –12 °C.
Затем в течение 4 минут лёд получает энергию, и его температура увеличивается до тех пор, пока не станет равной температуре плавления. При этом обратите внимание на то, что вещество в точке В— это ещё лёд — лёд, при температуре 0 °С. То есть молекулы ещё полностью сохраняют порядок, характерный для твёрдого тела.
Дальше мы с вами видим, что в течение следующих 4 минут температура остаётся постоянной, о чём свидетельствует горизонтальный участок графика ВС. Это участок плавления. На нём происходит агрегатное превращение льда в воду. И вся энергия, которую получает вещество при плавлении, расходуется на разрушение порядка в расположении молекул льда.
В точке С лёд полностью превратится в воду, которая также имеет температуру 0 °С. После этого температура снова начала увеличиваться, что соответствует участку графика CD. При этом жидкость всё ещё продолжает получать энергию. Достигнув отметки 15 °С (точка D на графике), воду перестали нагревать.
Следующий участок графика — участок DE. На нём мы видим, что вода начала остывать до нуля градусов. Следовательно, её внутренняя энергия уменьшается и выделяется теплота. При этом выделится столько же теплоты, сколько жидкость получила на участке CD. Вспомните — тело, при нагревании или охлаждении на одно и тоже число градусов, получает или отдаёт одно и то же количество теплоты.
Итак, в точке Е у нас вода, находящаяся при 0 °C. Далее, достигнув температуры кристаллизации, вода начала превращаться в лёд — участок графика EF. Это заняло около 6 минут, в течение которых температура вновь не менялась. При этом происходило выделение такого же количества энергии, какое вещество поглотило на участке ВС. Выделение энергии связано с восстановлением порядка в расположении молекул тела. Причём обратите внимание на то, что только в точке F вода полностью превратилась в лёд.
И последний участок графика соответствует охлаждению уже твёрдого тела до первоначальной температуры.
Конечно же вы знаете, что различные кристаллические вещества имеют разное строение — разные кристаллические решётки. Соответственно, для того чтобы её разрушить при температуре плавления, необходимо затратить разную энергию, то есть сообщить веществу разное количество теплоты.
Физическая величина, численно равная количеству теплоты, которое необходимо передать твёрдому телу массой один килограмм при температуре плавления для перехода в жидкость, называется удельной теплотой плавления.
Обозначается удельная теплота плавления греческой буквой лямбда. А единица её измерения — это джоуль на килограмм:

Конечно же разные вещества имеют разную удельную теплоту плавления, значение которой определяют экспериментально. Также различные эксперименты показали, что удельная теплота плавления равна удельной теплоте кристаллизации.

В таблице приведены значения удельной теплоты плавления для разных веществ и их температуры плавления.
Например, из таблицы видно, что удельная теплота плавления льда равна 333 000 Дж/кг. Это значит, что для перехода 1 кг льда, имеющей температуру 0 °С, из твёрдого состояния в жидкое он должен поглотить 333 000 Дж теплоты. При обратном переходе столько же теплоты выделяет каждый килограмм льда.

 Получите свидетельство
Получите свидетельство Вход
Вход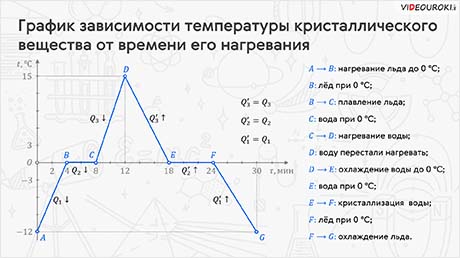




 2865
2865

