Азотная кислота и её соли
Азотная кислота – бесцветная жидкость, «дымит» на воздухе и окрашивается в жёлтый цвет, который придаёт ей оксид азота (IV), она обладает резким раздражающим запахом, кипит при температуре 83 0C, с водой смешивается в любых соотношениях.

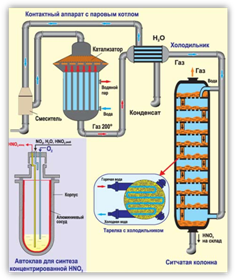
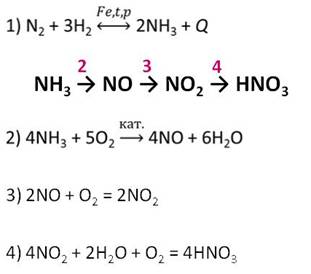
Сырьём для получения азотной кислоты в промышленности служат азот и водород. Азот превращают в аммиак, затем аммиак окисляют кислородом воздуха в присутствии катализатора до оксида азота (II), потом оксид азота (II) окисляют до оксида азота (IV), а при растворении оксида азота (IV) в воде и в присутствии кислорода воздуха образуется азотная кислота.
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на твёрдый нитрат натрия при незначительном нагревании.
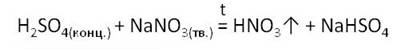
Способ получения азотной кислоты по обменной реакции открыт более трёхсот пятидесяти лет назад немецким химиком и аптекарем Глаубером. В результате взаимодействия нитрата калия с серной кислотой Глаубер получил «спиритус нутри» ― «дух селитры», а в России в старину азотную кислоту называли «селитряной дымистой водкой».


В водном растворе азотная кислота проявляет все свойства кислот. Она является сильной одноосновной кислотой, поэтому диссоциирует по первой ступени на ион водорода и анион кислотного остатка.
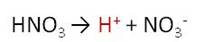
Азотная кислота, как и другие кислоты, реагирует с основными и амфотерными оксидами. Например, в реакции оксида магния с азотной кислотой образуется нитрат магния и вода, в реакции оксида алюминия с азотной кислотой, образуется соль – нитрат алюминия и вода.
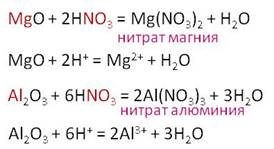
Азотная кислота реагирует с основаниями, как с растворимыми, так и нерастворимыми. В реакции взаимодействия гидроксида натрия с азотной кислотой, образуется соль – нитрат натрия и вода, в результате взаимодействия гидроксида меди (II) с азотной кислотой, также образуется соль – нитрат меди (II) и вода.
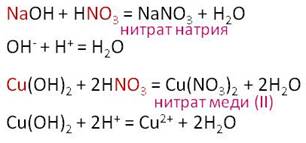
Азотная кислота вступает во взаимодействие с солями слабых кислот. Например, в реакции карбоната натрия с азотной кислотой образуется соль – нитрат натрия, углекислый газ и вода.
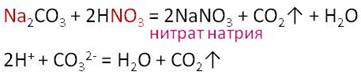
Азотная кислота является одним из сильнейших окислителей, за счёт азота в высшей степени окисления +5, поэтому она окисляет многие простые и сложные вещества.
Так, концентрированная азотная кислота реагирует практически со всеми металлами, расположенными в ряду активности как до, так и после водорода, кроме золота и платины. Так как окислителем в концентрированной азотной кислоте являются ионы кислотного остатка, а не ионы водорода, то при взаимодействии с металлами, водород не выделяется.
Например, если в пробирку с медными стружками осторожно прилить концентрированную азотную кислоту и немного подогреть, то можно увидеть, что раствор приобретает голубую окраску, из-за образования гидратированных ионов меди, а из раствора выделяется бурый газ – оксид азота (IV).
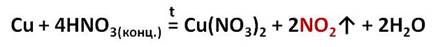
Некоторые металлы, такие как железо, алюминий, хром пассивируются в концентрированной азотной кислоте, поэтому концентрированную азотную кислоту хранят и перевозят в стальных или алюминиевых ёмкостях.



Разбавленная азотная кислота также является окислителем за счёт атома азота. Поэтому в реакции меди с разбавленной азотной кислотой образуется газ – оксид азота два и вода.
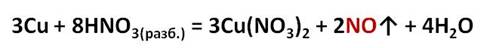

Молекулы азотной кислоты относительно нестойкие и концентрированная азотная кислота под действием теплоты и света частично разлагается на оксид азота четыре, кислород и воду.

Поэтому её хранят в прохладном тёмном месте.
Концентрированная азотная кислота окисляет многие органические вещества. Например, тлеющая лучинка, опущенная в склянку с нагретой концентрированной азотной кислотой, загорается ярким пламенем.

Скипидар, древесные опилки, солома и бумага воспламеняются при соприкосновении с концентрированной азотной кислотой. При взаимодействии азотной кислоты с белками образуются соединения жёлтого цвета. Если азотная кислота попадёт на кожу, то она может вызвать сильные химические ожоги и образование жёлтого пятна. Поэтому, если всё таки, она попала на кожу, то её сразу же нужно промыть большим количеством воды и нейтрализовать раствором питьевой соды.




При работе с азотной кислотой нужно соблюдать крайнюю осторожность: не допускать попадания её на кожу и одежду!
Смесь концентрированой азотной и соляной кислот в объёмном соотношении 1: 3 называется «царской водкой», потому что растворяет «царя металлов» ― золото и другие благородные металлы.
Соли азотной кислоты – нитраты. Нитраты натрия, калия, кальция и аммония называют селитрами. Например, NaNO3 – натриевая селитра, NH4NO3 – аммиачная селитра, KNO3 – калийная селитра, Ca(NO3)2 – кальциевая селитра. Все эти селитры применяют как азотные удобрения. Калийную селитру используют также при изготовлении чёрного пороха, а из аммиачной селитры готовят взрывчатое вещество – аммонал. Нитрат серебра, или ляпис, AgNO3 применяют в медицине для прижигания ран и язв.




Нитраты получают действием азотной кислоты на металлы, основные или амфотэрные оксиды, основания, аммиак, карбонаты.
Все нитраты – твёрдые кристаллические вещества, хорошо растворимые в воде. Они разлагаются с образованием кислорода. Например, при разложении нитрата калия образуется нитрит калия и кислород.

Поэтому, если мы кусочек раскалённого угля опустим в пробирку с расплавленным нитратом калия, то он ярко вспыхивает и сгорает.
Для определения нитрат-ионов поступают следующим образом: в пробирку помещают немного исследуемого вещества, затем добавляют медных стружек, а потом концентрированной серной кислоты и нагревают. В результате этих реакций образуется газ бурого цвета – оксид азота (IV), что свидетельствует о наличии нитрат-ионов в растворе.
Азотная кислота используется для получения удобрений, красителей, синтетических волокон, пластмасс, взрывчатых веществ, фотоплёнки и лекарств.

Таким образом, азотная кислота – это бесцветная дымящаяся на воздухе жидкость. В промышленности её получают из аммиака, а в лаборатории действием концентрированной серной кислоты на твёрдый нитрат натрия. Азотная кислота – сильный окислитель за счёт атома азота в степени окисления +5. Она проявляет свойства, типичные для всех кислот: диссоциирует с образованием ионов водорода аниона кислотного остатка, реагирует с основными и амфотэрными оксидами, основаниями и солями (карбонатами). Азотная кислота любой концентрации реагирует с металлами, стоящими до и после водорода (кроме золота и платины). Только железо, хром и алюминий пассивируются в концентрированной азотной кислоте. На свету или при нагревании азотная кислота разлагается. Соли азотной кислоты – нитраты. Большая часть получаемой азотной кислоты идёт на производство азотных удобрений.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 20710
20710

