Аммиак, соли аммония
В образовании молекулы аммиака принимают участие неспаренные электроны азота и водорода. На внешнем энергетическом уровне у азота 5 электронов, 2 спаренных и 3 неспаренных, именно они и участвуют в образовании химической связи. Три атома водорода предоставляют свои 3 неспаренных электрона, неспаренные электроны азота и 3 неспаренных электрона от трёх атомов водорода объединяются и образуется три ковалентные связи.

Эти электронные пары смещены в сторону более электрооотрицательного элемента – азота. Молекула аммиака имеет вид треугольной пирамиды, причём из-за смещения электронный пары к азоту возникает диполь, в котором есть положительный и отрицательный полюс.

В жидком состоянии молекулы аммиака связываются друг с другом при помощи водородной связи.

По физическим свойствам, аммиак представляет собой бесцветный газ с резким запахом, почти в два раза легче воздуха. Аммиак хорошо растворим в воде: в одном объёме воды растворяется семьсот объёмов аммиака. 20% по массе раствор аммиака называется водным аммиаком или аммиачной водой, а 10% раствор аммиака, который используется в медицине, называется нашатырным спиртом.
Аммиак нельзя вдыхать продолжительное время, так как он ядовит. Достаточно легко сжижается при обычном давлении и температуре 33,4 0С. Жидкий аммиак при испарении вызывает сильное охлаждение, поэтому его используют в холодильных установках.
В водном растворе аммиака образуется гидрат аммония – непрочное соединение. Поэтому раствор аммиака проявляет основные свойства. Его раствор в воде имеет щелочную среду: pH > 7.
![]()
Если в раствор аммиака добавить несколько капель фенолфталеина, раствор станет малинового цвета, за счёт гидроксид-ионов, если этот окрашенный раствор подогреть, то окраска исчезает, так как аммиак улетучивается в виде газа.

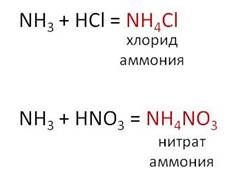
Аммиак реагирует с кислотами с образованием солей аммония. Например, Если стеклянную палочку, смоченную раствором аммиака, поднести к другой палочке, смоченной соляной кислотой, то появится густой дым – это образуется соль аммония – хлорид аммония.


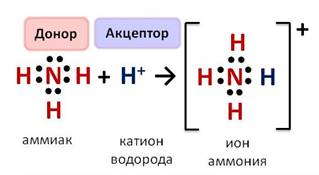
В этой соли катион аммония выступает в роли катиона металла. Катион аммония образуется за счёт объединения неподелённой пары электронов азота и катиона водорода, который переходит к аммиаку от молекул кислот или воды. В результате этого объединения возникает ковалентная связь и образуется катион аммония. В этом катионе валентность азота равна IV, так как образовалось четыре связи, а степень окисления азота -3.

Механизм образования ковалентной связи, которая возникает за счёт свободной электронной пары одного из атомов, называется донорно-акцепторным.
Поэтому при образовании катиона аммония донором электронной пары является азот, а акцептором катион водорода кислоты или воды.
Соли аммония называются по аналогии с другими солями. Например: NH4NO3 – нитрат аммония, (NH4)2SO4 – сульфат аммония, (NH4)2CO3 – карбонат аммония. Все соли аммония – твёрдые кристаллические вещества, хорошо растворимые в воде, по свойствам они схожи с солями калия.



Как и все соли, они реагируют с другими солями. Например, в результате взаимодействия хлорида аммония с нитратом серебра, образуется нерастворимая в воде соль – хлорид серебра в виде белого творожистого осадка и другая соль – нитрат аммония.

В результате взаимодействия сульфата аммония с хлоридом бария образуется осадок – сульфат бария и ещё одна соль – хлорид аммония.
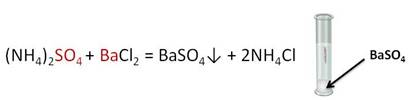
Некоторые соли аммония, как карбонат аммония, реагирует с кислотами.
Например, в результате взаимодействия карбоната аммония с соляной кислотой образуется соль – хлорид аммония и угольная кислота, которая распадается на углекислый газ и воду.

Соли аммония разлагаются при нагревании. При нагревании хлорида аммония образуется аммиак и хлороводород.

Если охладить продукты реакции, то они вновь соединяются и образуется соль. Таким образом, при нагревании сухой хлорид аммония как бы возгоняется, а затем на холодных стенках верхней части пробирки снова оседает в виде белых кристалликов.
Для аммиака характерны реакции окисления. При окислении аммиака кислородом образуется азот и вода. В этой реакции азот повышает свою степень окисления с -3 до 0, а кислород понижает с 0 до -2. Поэтому азот является восстановителем, а кислород – окислителем.

В присутствии катализатора (Pt) окисление аммиака идёт не до азота, а до оксида азота (II) и воды. В этой реакции азот изменяет свою степень окисления с -3 до +2, а кислород понижает с 0 до -2. Поэтому азот является восстановителем, а кислород – окислителем.
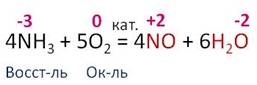
Аммиак восстанавливает некоторые металлы из их оксидов. Так в реакции аммиака с оксидом меди (II) образуется азот, медь и вода. Это окислительно-восстановительная реакция, в которой медь понижает свою степень окисления с +2 до 0, а азот повышает с -3 до 0. Поэтому медь выступает в роли окислителя, а азот в роли восстановителя.

В промышленности аммиак получают синтезом азота и водорода при высоких температуре, давлении и в присутствии катализатора.

В лаборатории аммиак получают действием гашёной извести на соли аммония.
Например, при действии гашёной извести на хлорид аммония образуется соль – хлорид кальция, газ аммиак и вода.
![]()
Аммиак легче воздуха, его собирают в перевёрнутый вверх дном сосуд, а распознают по запаху или посинению влажной лакмусовой бумажки.

Такие реакции являются качественными на соли аммония.
Проведём эксперимент: нальём в одну пробирку раствор хлорида натрия, а в другую хлорид аммония. Затем в каждую из пробирок ещё добавим раствора щёлочи и нагреем содержимое двух пробирок. Поднесём к отверстию пробирок влажную лакмусовую бумажку. При этой в первой пробирке бумажка не изменила своего цвета, а в другой пробирке стала синего цвета за счёт выделения аммиака, кроме этого аммиак можно распознать и по характерному резкому запаху.

Соли аммония получают реакцией аммиака с кислотами. Напрмер, в результате взаимодействия аммиака и соляной кислоты, образуется соль – хлорид аммония, в результате взаимодействия аммиака и азотной килслоты, образуется соль – нитрат аммония.
Аммиак и его соли находят широкое применение: его используют в холодильных установках как хладагент, в производстве минеральных удобрений, особенно ценным удобрением считается нитрат аммония, аммиак применяется в производстве азотной кислоты. Соли аммония используются для паяния, например, хлорид аммония очищает поверхность металла от оксидной плёнки, аммиак и соли аммония используют для получения взрывчатых веществ, например, нитрат аммония в смеси с порошком алюминия и угля образует вещество – аммонал, который применяют при разработке горных пород. Аммиак и соли аммония также необходимы для получения красителей.



В медицине и в быту используют нашатырный спирт, потому что он стимулирует работу сердца и нервной системы, его дают нюхать при обмороках и отравлениях. Аммиак широко применяют в быту при стирке белья и выведении пятен, чистке ковров и ювелирных изделий. Гидрокарбонат и карбонат аммония применяются в изготовлении кондитерских изделий, так как эти соединения легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным.

Таким образом, молекула аммиака имеет форму пирамиды, на вершине которой расположен атом азота. В аммиаке степень окисления азота -3. Аммиак – бесцветный газ, с резким запахом, хорошо растворим в воде. В промышленности аммиак получают синтезом азота и водорода, в лаборатории нагреванием хлорида аммония с гашёной известью, в реакциях он проявляет окислительные и восстановительные свойства. Аммиак реагирует с водой, кислотами. В результате реакций с кислотами образуются соли аммония. Взаимодействие солей аммония со щелочами служит качественной реакцией на ион аммония.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 16672
16672

