Сера, соединения серы
Немало сера знаменита,
И в древности её Гомэр воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.


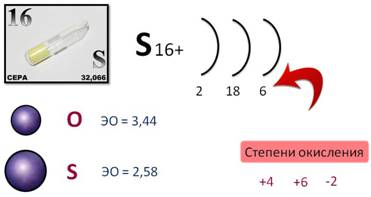
Сера – элемент VI A группы, значит, на внешнем энергетическом уровне у неё шесть электронов. По сравнению с кислородом, радиус атома серы больше, меньшее значение электроотрицательности, поэтому восстановительные свойства у неё выражены сильнее. Для серы характерны такие степени окисления, как +4, +6, а в соединении с менее электроотрицательным элементом, её степень окисления -2.
Для серы характерна аллотропия. Сера существует в трёх аллотропных модификациях: ромбической, моноклинной, пластической.
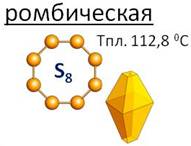
Наиболее известна ромбическая сера. В узлах её кристаллической решётки находятся циклические восьмиатомные молекулы, которые напоминают корону, атомы серы здесь соединены одинарными ковалентными связями. Ромбическая сера – хрупкое жёлтое вещество, легко измельчается в порошок.
Её кристаллы имеют вид октаэдров со срезанными углами. Эти кристаллы окрашены в лимонно-жёлтый цвет, их температура плавления 112,8 0С. При комнатной температуре в эту модификацию превращаются все остальные модификации.
Моноклинная сера получается при кристаллизации из расплава, она представляет собой игольчатые кристаллы, температура плавления которых 119,3 0С.

При нагревании кусочков серы в пробирке она плавится, превращается в жидкость жёлтого цвета. При температуре 160 0С жидкая сера начинает темнеть, приобретая прежний тёмно-коричневый цвет. Если её вылить в холодную воду, то она застывает в виде прозрачной резинообразной массы. Это и есть пластическая сера в виде нитей. Но через несколько дней она также превращается в ромбическую серу.

Сера не растворяется в воде, кристаллы серы в воде тонут, а порошок плавает по поверхности, но она хорошо растворима в сероуглероде.

Сера была известна людям ещё с глубокой древности. Своё название она получила от санскритского слова сира, что значит «светло-жёлтый». В Древнем Египте сера применялась для приготовления красок, беления тканей и изготовления косметических средств. А в Древнем Риме серу применяли для лечения кожных болезней, в Древней Греции её сжигали в целях дезинфекции воздуха в помещении.


В романе Дюма «Граф Монте-Кристо» аббат Фариа притворился, что у него кожная болезнь, и ему для лечения дали серу, которую он в дальнейшем использовал для изготовления пороха.


Сера вступает в реакции с металлами. Например, в реакции серы с кальцием образуется сульфид кальция. Кальций повышает свою степень окисления с 0 до +2, а сера понижает с 0 до -2. В этой реакции кальций – восстановитель, а сера – окислитель.

Сера вступает в реакцию и с ртутью, при этом образуется сульфид ртути (II). Ртуть повышает свою степень окисления с 0 до +2, а сера понижает степень окисления с 0 до -2. Ртуть выступает в роли восстановителя, а сера – в роли окислителя. Эта реакция лежит в основе удаления и обезвреживания разлитой ртути. Такой процесс называется дэмеркуризацией.

Сера вступает в реакцию с водородом. В результате этой реакции образуется сероводород. Водород повышает свою степень окисления с 0 до +1, а сера понижает с 0 до -2. В этой реакции водород выступает в роли восстановителя, а сера – в роли окислителя.
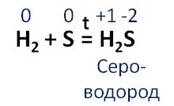
Сера реагирует с кислородом с обрзованием сернистого газа. В этой реакции сера повышает свою степень окисления с 0 до +4, а кислород понижает с 0 до -2. Сера является восстановителем, а кислород – окислителем.

Проведём эксперимент: наберём в ложечку для сжигания веществ немного серы и нагреем на пламени спиртовки. Сера горит, но на воздухе горение почти незаметно. Опустим горящую серу в колбу с кислородом, сера горит ярким синим пламенем. При этом выделяется газ с характерным резким запахом.

В природе сера встречается в самородном состоянии и в виде соединений. Вам уже известны такие природные соединения серы, как цинковая обманка – ZnS, киноварь – HgS, свинцовый блеск – PbS, пирит, или колчедан – FeS2, CuS – медный блеск, глауберова соль – Na2SO4 ∙ 10H2O, гипс – CaSO4 ∙ 2H2O, горькая, или английская соль – MgSO4 ∙ 7H2O.


Сера – жизненно важный химический элемент. Она входит в состав некоторых белков, витаминов и гормонов. Сера участвует в окислительно-восстановительных процессах организма, при недостатке серы в организме наблюдаентся хрупкость и ломкость костей, выпадение волос.
Серой богаты бобовые растения, овсяные хлопья и яйца.


Серу используют в производстве спичек и бумаги, резины и красок, взрывчатых веществ и лекарств, косметических препаратах. В сельском хозяйстве её применяют для борьбы с возбудителями грибных и бактериальных болезней, вредителями растений. Около половины добываемой серы идёт на производство серной кислоты.

Сероводород – H2S – одно из соединений серы. Сероводород представляет собой бесцветный газ с резким запахом, он ядовит и вызывает отравление даже при незначительном содержании в воздухе. В одном объёме воды растворяется 2,5 объёма сероводорода. Сероводород может накапливаться в организме, соединяясь с железом гемоглобина, что может привести к обморочному состоянию. Сероводород входит в состав некоторых минерльных вод, применяемых с лечебной целью.
Сероводород содержится в вулканических газах и постоянно образуется на дне Черного моря. Он образуется при гниении белка.
При растворении в воде сероводорода образуется слабая сероводородная кислота. Соли сероводородной кислоты называют сульфидами. Сульфиды щелочных и щелочноземельных металлов и сульфида аммония хорошо растворимы в воде, остальные сульфиды нерастворимы и окрашены в различные цвета. Например, сульфид цинка – ZnS – белого цвета, сульфид свинца (II) – PbS – чёрного цвета, сульфид марганца (II) – MnS – розового цвета.
В лаборатории сероводород получают действием соляной кислоты на сульфид железа (II).
![]()
Сероводород горит с образованием сернистого газа и воды.

Но если охладить это пламя, то образуется не сернистый газ, а свободная сера.

В реакциях сероводород является восстановителем, потому что у серы здесь минимальная степень окисления.
Раствор сероводорода в воде – сероводородная кислота.

Поэтому диссоциирует с образованием гидросульфид-иона и сульфид-иона.

Качественной реакцией на сероводородную кислоту и её соли является взаимодействие с растворами солей свинца (II). При этом образуется осадок сульфида свинца (II) чёрного цвета.

Сера образует ещё одно соединение – оксид серы (IV), которое образуется при сгорании серы. Это бесцветный газ с резким запахом, тяжелее воздуха и ядовит.

В промышленности оксид серы (IV) получают при горении серы и полном сгорании сероводорода при обжиге руд.

В лаборатории его получают действием кислот на сульфиты. Например. При взаимодействии сульфита натрия и серной кислоты образуется гидросульфат натрия сернистый газ и вода.
![]()
Оксид серы (IV) – кислотный оксид, проявляет все свойства, характерные для кислотных оксидов. При растворении в воде он образует сернистую кислоту. Эта неустойчивая кислота, которая разлагается на исходные вещества.
H2O + SO2 ↔ H2SO3
Соли сернистой кислоты назывются сульфитами. Эта кислота может образовывать средние и кислые соли. Например, Na2SO3 – сульфит натрия – средняя соль, NaHSO3 – гидросульфит натрия – кислая соль. Эти две соли используют при отбеливании шерсти, шёлка, бумаги и соломы, в качестве консервирующих средств.
Таким образом, сера – элемент VI A группы, у неё шесть электронов на внешнем энергетическом уровне. В соединениях она проявляет степени окисления +4, +6 и -2. Поэтому в реакциях она проявляет восстановительные и окислительные свойства. Для серы характерны аллотропные модификации. Сера в природе находится в свободном состоянии и в виде соединений. Наиболее распространёнными соединениями серы является оксид серы (IV) и сероводород. Сера и её соединения находят широкое применение во многих областях народного хозяйства.

 Получите свидетельство
Получите свидетельство Вход
Вход



 1
1 25438
25438


ht