Химические реакции – это явления, которые сопровождаются превращением веществ.
Рассмотрим на конкретном примере, что же представляют собой химические реакции. Смешаем железные опилки и порошок серы в отношении 7 : 4. В результате получилась смесь, в которой каждое вещество сохраняет свои свойства. Как вы помните, эту смесь можно разделить, поднеся к ней магнит, при этом, железные опилки притянутся к магниту.
Если смесь железных опилок и порошка серы нагреть, то начинается химическая реакция, в результате которой образуется новое сложное вещество. Свойства этого сложного вещества отличаются от свойств железа и серы. Полученное соединение не притягивается магнитом, тонет в воде, не ржавеет, не горит.
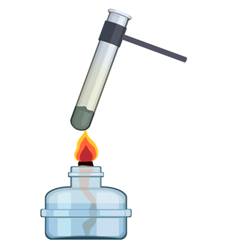
Эту реакцию можно записать словами, а можно с помощью химических формул и знаков:
Fe + S = FeS
Железо + сера = сульфид железа
Для того чтобы между исходными простыми веществами прошла реакция, нужны следующие условия: во-первых – это соприкосновение веществ, а во-вторых – это нагревание.
Таким образом, соприкосновение реагирующих веществ – это обязательное условие для любой химической реакции.
Проведём небольшой эксперимент: в пробирку с кусочками мрамора добавим соляной кислоты. Происходит бурное выделение пузырьков газа. Опустим газоотводную трубку, через которую выделяется газ в пробирку с известковой водой, при этом происходит помутнение известковой воды.
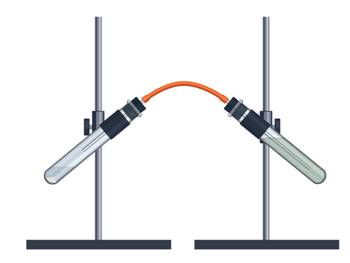
Из проведённого опыта можно сделать вывод: во-первых, прошла химическая реакция, так как в первом случае выделяется газ, а во втором происходит помутнение известковой воды.
Запишем эти химические уравнения словами:
мрамор + соляная кислота = хлорид кальция, углекислый газ и вода,
углекислый газ + известковая вода = карбонат кальция и вода.
Если записать эти уравнения с помощью формул, то получатся следующие записи:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3↓ + H2O
В данных реакция нагревания не требовалось, в отличие от предыдущего опыта.
Есть такие реакции, которые протекают очень медленно, и для того, чтобы их ускорить используют вещества, которые называются катализаторами.
Таким образом, катализаторы – это вещества, которые ускоряют химические реакции, но сами при этом не расходуются.
Биологические катализаторы называют ферментами, или энзимами.
Проведём эксперимент, в котором используется катализатор. Нальём в стакан перекиси водорода. Добавим сюда диоксид марганца, при этом наблюдается бурное выделение газа. Этим газом является кислород, чтобы это доказать, достаточно поднести тлеющую лучинку, она вспыхнет. То есть диоксид марганца в нашем случае является катализатором, который ускорил химическую реакцию.

Запишем эту реакцию словами:
пероксид водорода разлагается с образованием воды и кислорода.
Если реакцию записать с помощью формул, то она имеет следующий вид:
2H2O2 → 2Н2О + О2↑
Таким образом, для ускорения протекания этой реакции требуется катализатор.
Знание условий протекания реакций позволяет ускорять, замедлять и прекращать химические реакции. Прекращение химических реакций используют при тушении пожаров. Для того чтобы остановить процесс горения, нужно исключить доступ кислорода. Для этого горячие предметы заливают водой, пеной, засыпают песком, набрасывают плотную ткань или используют огнетушитель.


 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 10180
10180

