Электролизом называется окислительно-восстановительная реакция, которая протекает на электродах при пропускании через раствор или расплав электролита электрического тока.
Электролиз, или электрометаллургия – это один из способов получения металлов. Различают электролиз расплавов и растворов. Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
Особенностью электролиза водных растворов является то, что он не требует энергетических затрат на расплавление вещества. Но электролиз растворов пригоден для тех металлов, которые стоят правее алюминия.
При электролизе водных растворов солей происходит не только восстановление металлов на катоде и окисление анионов соли на аноде, но идёт ещё и электролиз воды, при котором на катоде выделяется водород, а на аноде – кислород.
Для составления уравнения электролиза следует выполнить следующие действия. Во-первых, составить уравнение диссоциации. Во-вторых, показать перемещение ионов к соответствующим электродам, в-третьих – составить схемы процессов восстановления и окисления, в четвёртых, составить суммарное уравнение электролиза.
Электролизу подвергаются расплавы оксидов, гидроксидов или хлоридов. При электролизе расплава на катоде всегда восстанавливается катион электролита, а на аноде всегда окисляется анион электролита. Кислородсодержащие анионы на аноде претерпевают разрушение: сульфат-ион до оксида серы (VI), а карбонат-ион – до оксида углерода (IV).
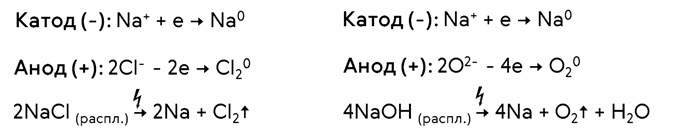
Например, при электролизе расплава хлорида натрия, продуктом восстановления, выделяющимся на катоде, является натрий, а продуктом окисления, который образуется на аноде, – хлор. Таким образом, при электролизе расплава хлорида натрия образуется натрий и хлор.
При электролизе расплава гидроксида натрия, на катоде образовывается натрий, а на аноде – кислород. Таким образом, при электролизе расплава гидроксида натрия образуется натрий, кислород и вода.
Современный способ получения алюминия был изобретён в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. При электролизе оксида алюминия при этом образуется алюминий и кислород.
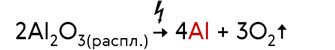
При электролизе расплава сульфата натрия на катоде образуется натрий, а на аноде кислород и оксид серы (VI). При электролизе расплава карбоната калия на катоде образуется калий, а на аноде – кислород и оксид углерода (IV).
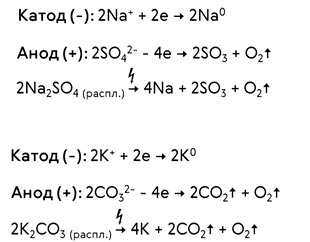
Получить щелочные и щелочноземельные металлы электролизом водных растворов их солей нельзя, так как на катоде будет происходить восстановление и выделение водорода, а не металла. Но этим способом можно получить техническую щёлочь:
Катод: 2H2O + 2e → H20↑ + 2NaOH
Анод: 2Cl- - 2e → Cl20↑
Cуммарное уравнение: 2NaCl + H2O → H2↑ + Cl2↑ + 2NaOH
Следует запомнить, как правильно составить уравнения электролиза раствора соли.
Если в состав соли входит металл, расположенный в ряду активности до алюминия, то на катоде идёт образование водорода; если металл в ряду активности от алюминия до водорода, то на катоде идёт два параллельных процесса: это образование водорода и металла; если металл в составе соли находится после водорода, то на катоде образуется металл. Катодные процессы справедливы для любых электродов.
Если в составе соли анионы бескислородной кислоты (кроме F- фторид-ионов), то на аноде образуются простые вещества; если в составе соли анионы кислородсодержащих кислот и фторид-ионы, то на аноде выделяется кислород и соответствующая кислота. Это правила справедливо для нейтральной и кислой среды. В щелочной среде на аноде образуется не кислота, а вода.

Эти все правила справедливы, если электроды инертные (угольные, графитовые, из золота или платины). Если анод растворимый, то есть из железа, меди, цинка или серебра, то независимо от природы аниона всегда идёт окисление металла анода (Ме → Меn+).
Если в составе соли анионы карбоновых кислот, то происходит образование углекислого газа и выделяется алкан, вследствие сдваивания алкильных радикалов. CO2↑
При электролизе водных растворов щелочей и кислородсодержащих кислот электролизу подвергается вода, то есть образуется водород и кислород.
Составим уравнение электролиза раствора сульфата натрия на инертных электродах. Рассуждаем так. Эта соль образована металлом натрием, который в ряду активности стоит левее алюминия, значит, на катоде будет образовываться водород. В составе соли – анион кислородсодержащей кислоты, значит, на аноде образовывается кислород. То есть электролизу в данном случае будет подвергаться вода:
2Н2О → 2Н2↑ + О2↑
Катод: 2H2O + 2e → H20↑ + 2OH-
Анод: 2H2O - 4e → О20↑ + 4Н+.
Составим уравнение электролиза раствора хлорида меди (II) на инертных электродах. Эта соль образована металлом, который стоит в ряду активности после водорода, значит на катоде образуется металл, а на аноде – простое вещество – хлор, так как в составе соли анион бескислородной кислоты:
Катод: Cu2+ + 2e → Cu0
Анод: 2Cl- - 2e → Cl20↑
CuCl2 → Cu + Cl2↑.
Составим уравнение электролиза раствора сульфата меди (II) на инертных электродах. Эта соль образована металлом, который стоит в ряду активности после водорода, значит, на катоде образуется металл, а на аноде – кислород и серная кислота, так как соль образована кислородсодержащей кислотой:
Катод: Cu2+ + 2e → Cu0
Анод: 2H2O- - 4e → O20↑ + 4H+
2CuSO4 + 2H2O → 2Cu↓ + O2↑ + 2H2SO4.
Составим уравнение электролиза водного раствора йодида кальция на инертных электродах. Ион кальция, который входит в состав соли находится в ряду активности до алюминия, поэтому на катоде образуется водород, на аноде, так как это анион бескислородной кислоты, образуется простое вещество йод. То есть в результате электролиза получается водород, йод и гидроксид кальция:
Катод: 2H2O + 2e → Н20↑ + 2ОН-
Анод: 2I- - 2e → I20
CaI2+ 2H2O → H2↑ + I2 + Ca(OH)2.
Cоставим уравнение электролиза водного раствора сульфата цинка на угольных электродах. Цинк находится в ряду активности правее алюминия, но левее водорода, значит на катоде идёт образование и металла и водорода. На аноде образуется кислород и серная кислота, так как в составе соли – анион кислородсодержащей кислоты:
Катод: Zn2+ + 2e → Zn0
2H2O + 2e → Н20↑ + 2ОН-
Анод: 2H2O- - 4e → O20↑ + 4H+
ZnSO4 + 2H2O → 2Zn↓ + H2↑ + O2↑ + H2SO4.

 Получите свидетельство
Получите свидетельство Вход
Вход




 981
981