На прошлых уроках мы с вами говорили о том, что в природе существует два вида электрических зарядов — положительный и отрицательный, что связано с их компенсирующим взаимным действием.
Так же мы выяснили, что электрический заряд любого заряженного тела дискретен, то есть кратен наименьшему элементарному заряду — заряду электрону.
Давайте вспомним, что электрон — это очень маленькая частица, гораздо меньше атома или молекулы. Также была найдена и частица, обладающая элементарным положительным зарядом. Это протон.
Таким образом в начале XX в. было достоверно известно, что в состав атома входят отрицательно заряженные частицы — электроны, и частицы с положительным зарядом, т. е. протоны. Однако их взаимное расположение в атоме было вовсе не очевидным.
Первая модель атома была предложена английским учёным Дж. Томсоном в тысяча девятьсот четвёртом году. Согласно его модели, атом представляет собой однородный шар из положительно заряженного вещества, внутри которого находятся электроны. Причём число электронов полностью компенсирует суммарный положительный заряд атома.

Эта модель чем-то напоминала булочку с изюмом. Отсюда и произошёл термин «пудинговая модель атома».
Но предложенная Томсоном модель оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме, которые были проведены в тысяча девятьсот одиннадцатом году английским физиком Э. Резерфордом.
Суть его опыта можно понять из такого сравнения. Пусть нужно проверить, однородно ли какое-либо тело. Например, не спрятана ли гиря в стоге сена, не дотрагиваясь до стога. Для этого будем использовать мелкокалиберную винтовку и большой фанерный щит. Начнём стрелять в стог по различным направлениям и внимательно следить по пробоинам в щите за траекториями всех пуль. Если в стогу гиря не спрятана, то есть стог сена является однородным, то не будет ни одного рикошета.

Они появятся только при наличии в стоге предмета, причём число рикошетов будет зависеть от размеров этого предмета (например, эта торговая килограммовая гиря, или же гимнастическая двухпудовая).

В опытах Резерфорда тончайшая плёнка из золота обстреливалась положительно заряженными частицами и оценивались траектории их движения после прохождения плёнки. Опыты Резерфорда (более подробно о них пойдёт речь в старших классах) убедительно показали, что атом очень неоднороден.
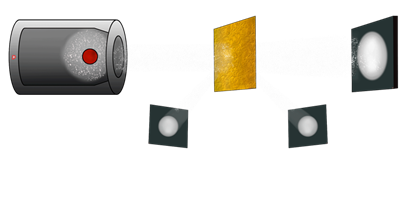
Иначе, как объяснить, что некоторые положительно заряженные частицы изменяли направление движения, хотя их число было чрезвычайно малым.
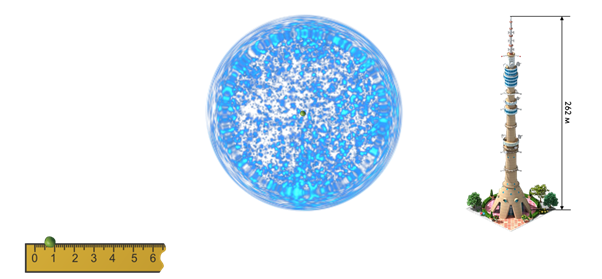
Опыт позволил утверждать, что более 99,9% десятых процента его массы и весь положительный заряд сосредоточены в чрезвычайно малой области в центре атома, которую назвали ядром атома. Резерфорд оценил размер этого ядра — его поперечник примерно в 100 000 раз меньше поперечника самого атома. Чтобы представить себе, что это означает, рассмотрим такую наглядную модель. Представьте себе, что атомное ядро увеличено до размеров горошины. Тогда диаметр атома был бы равен высоте Останкинской телебашни.
В 1919 г. Резерфордом были экспериментально обнаружены носители положительного заряда ядра — протоны. Название частиц происходит от греческого слова первичный, основной, что подчёркивает то, что протоны являются основой, базой ядер всех без исключения атомов.
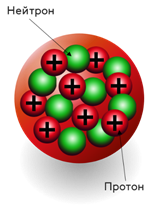
Кроме протонов, в ядре также находятся электронейтральные частицы — нейтроны, которые были открыты английским учёным Дж. Чедвиком.
Таким образом, было установлено, что вокруг ядра, состоящим из протонов и нейтронов, удерживаемые взаимодействием с ним, на очень большом расстоянии непрерывно движутся отрицательно заряженные электроны.
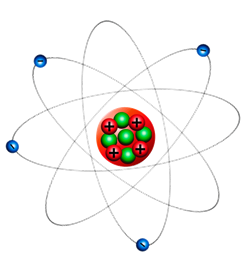
Возникает закономерный вопрос: Почему же отрицательные, обладающие малой массой электроны атома не устремятся к ядру и не соединятся с массивным положительно заряженным ядром? Оказывается, по той же причине, по которой наша Земля не падает на притягивающее её с гигантской силой Солнце. Электроны, подобно планетам Солнечной системы, вращаются вокруг ядра, но только вращение это гораздо более быстрое.
Так, в атоме водорода его единственный электрон за одну секунду делает вокруг ядра около семи квадриллионов оборотов! Попытайтесь представить время его пребывания на небольшом участке траектории!
Из-за того, что поведение электронов подобно поведению планет в нашей Солнечной системе, модель строения атома, вытекающую из опыта Резерфорда, называют планетарной моделью.
Выдающийся русский учёный Дм. И. Менделеев заметил периодическую повторяемость свойств элементов по мере роста атомной массы, с чем вы познакомитесь в курсе химии. Мы же с вами обратим внимание на другое обстоятельство: так как всякий атом нейтрален, то число электронов на орбитах обязательно равно числу протонов в ядре.
Например, самый простой из встречающихся в природе атомов — атом водорода — состоит из одного протона и вращающегося вокруг него одного электрон.

Второй по сложности — это атом гелия. В его ядре два протона и два нейтрона, а вокруг вращаются два электрона.
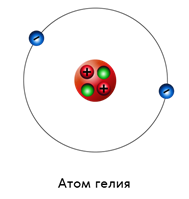
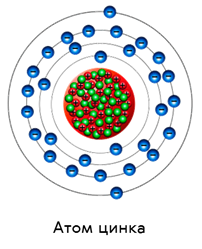
Из такого сравнения не трудно заметить, что в нейтральном атоме число электронов равно числу протонов. А вот число нейтронов может быть разным. Так, например, у атома цинка тридцать протонов и электронов, а вот нейтронов — тридцать пять.
Сравнивая строение атома со строением нашей Солнечной системы, не будем забывать о том, что наша планетная система практически лишена возможности столкновения с себе подобной, в то время как столкновения атомов друг с другом следуют неизбежно и непрерывно. Так, даже в обычном воздухе, где молекулы расположены в среднем на значительных расстояниях, каждая из них испытывает за одну секунду около миллиарда столкновений! При таких столкновениях чрезвычайно часто, особенно при повышении температуры, может происходить потеря атомом одного и даже более электронов, что приводит к нарушению электрической нейтральности.
Частица, потерявшая электрон, обладает нескомпенсированным положительным зарядом. Такую частицу называют положительным ионом, а произошедший процесс, который привёл к появлению вместо нейтральной частицы (атома) двух разноименно заряженных частиц (электрона и иона) — ионизацией.
Говоря об ионизации, нужно отметить, что этим термином в физике описывают не только процесс образования электрона и положительного иона, но и появление отрицательных ионов. Все дело в том, что электрон не только может быть потерян нейтральным атомом, но и приобретен им от другого атома. Например, в обычной поваренной соли (соединение атома натрия и хлора) атом натрия легко теряет электрон, который переходит к атому хлора, что приводит к появлению пары разноимённых ионов.
Само слово «ион» (от греческого идущий) говорит о способности этих частиц передвигаться при взаимодействии с другими заряженными частицами. Именно благодаря движениям ионов обоих знаков осуществляется проводимость в жидкостях.
Заметим в заключение, что физические свойства тел зависят не только от строения их атомов, но и от расположения и взаимодействия этих атомов друг с другом. Например, довольно мягкий и являющийся хорошим проводником графит очень мало похож на самое твердое природное вещество, обладающее великолепными изолирующими свойствами, — алмаз, хотя атомы, образующие их, одинаковы — это атомы углерода, имеющие в этих веществах различное взаимное расположение.


 Получите свидетельство
Получите свидетельство Вход
Вход




 4918
4918


