Все вещества, входящие в состав клеток, подразделяются на неорганические (макро- и микроэлементы) и органические.
К неорганическим веществам относятся вода и минеральные вещества.
Основные классы органических соединений биологического происхождения — это углеводы, липиды, белки, нуклеиновые кислоты.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
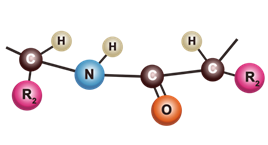
Белки построены из мономеров, которыми являются аминокислоты. Выделяют 20 аминокислот, которые входят в состав белков.
Все аминокислоты подразделяют на заменимые и незаменимые.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула
аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из
которых является аминогруппой (─N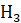 ),
с основными свойствами, другая — карбоксильной группой (─COOH) с
кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах
она обычно обозначается большой латинской буквой R),
у разных аминокислот имеет различное строение.
),
с основными свойствами, другая — карбоксильной группой (─COOH) с
кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах
она обычно обозначается большой латинской буквой R),
у разных аминокислот имеет различное строение.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется полимеризацией.
Также белки могут состоять и из большого числа аминокислотных остатков. И кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
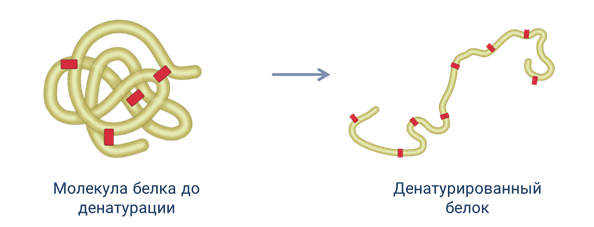
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
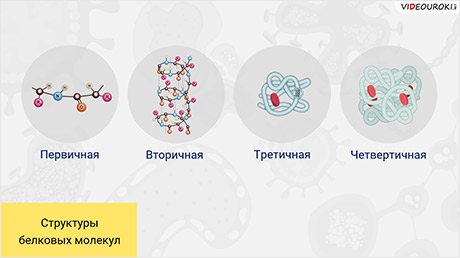
Молекулы белков могут принимать различные пространственные формы — конформации, которые представляют собой четыре уровня их организации.
Выделяют первичную структуру белковой молекулы, вторичную, третичную и четвертичную.
Белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Функции белков зависят от их строения. От последовательности, аминокислот, которые составляют их основу.
Рассмотрим основные функции белков.
Структурная функция. Так как белки являются основой всех биологических мембран, они выполняют строительную функцию. Например, белок коллаген — важный составной компонент соединительных тканей.
Ферментативная функция белков. Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев.
Ферменты специфичны для каждого вещества. Основная их функция — это ускорение биохимических реакций организма, реакций распада и синтеза.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Регуляторная функция белков.
Она присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови.
Белки могут выполнять и энергетическую функцию, являясь одним из источников энергии в клетке.
Поступившие с пищей белки расщепляются в желудке. Далее под влиянием ферментов в двенадцатиперстной кишке завершается расщепление белков до аминокислот. Затем аминокислоты в виде водных растворов всасываются в кровь капиллярами ворсинок тонкого кишечника.
Кровеносные сосуды, отходящие от кишечника, поступают в воротную вену, которая собирает кровь от желудка, селезёнки, кишечника в печень.
Печень играет важную роль в обмене белков. Здесь образуются не только собственные белки клеток печени, но и большое количество секретируемых белков, необходимых для нужд всего организма.
После синтеза белки имеют первичную структуру. Затем для того, чтобы осуществлять свои биологические функции, они сворачиваются в одну или несколько особых пространственных конфигураций. То есть приобретают вторичную, третичную или четвертичную структуру.
В какой последовательности должны располагаться аминокислоты?
Информация о первичных структурах белков закодирована в последовальности нуклеотидов в молекуле нуклеиновой кислоты ― двухцепочечной ДНК. Эта информация называется генетической информацией. А участок ДНК, в котором содержится информация о первичной структуре одного белка, называется геном.
Нуклеиновые кислоты получили своё название исходя из места их наибольшей концентрации. В ядрах клеток их наибольшее количество. Ядро — от латинского «нуклеус». Поэтому и кислоты называют нуклеиновыми.
Помимо ядра, нуклеиновые кислоты также обнаружены в цитоплазме, митохондриях и пластидах.
Нуклеиновые кислоты состоят из мономеров — нуклеотидов. А нуклеотиды состоят из фосфорной группы, пятиуглеродного сахара (пентозы) и азотистого основания.
В зависимости от углеводного компонента нуклеотидов различают два класса нуклеиновых кислот: рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Они различаются по составу и строению молекул, а также по выполняемым в клетке функциям.
Название кислот обусловлено тем, что молекула РНК содержит рибозу, а ДНК содержит дезоксирибозу.
Молекулы ДНК — это полимеры, мономерами которых являются дезоксирибонуклеотиды, образованные: остатком пятиуглеродного сахара — дезоксирибозы; остатком фосфорной кислоты и остатком одного из азотистых оснований.
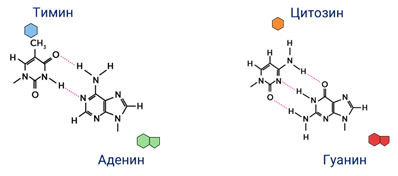
Азотистые основания, которые являются производными пурина, называют пуриновыми. К ним относят аденин и гуанин.
Азотистые основания, которые являются производными пиримидина, называют пиримидиновыми. К ним относят цитозин, тимин.
Азотистые основания определяют названия соответствующих нуклеотидов: адениловый, гуаниловый, тимидиловый и цитидиловый.
ДНК состоит из двух спирально закрученных полинуклеотидных цепей, которые по всей длине соединены друг с другом водородными связями. Такую структуру, свойственную только молекулам ДНК, называют двойной спиралью.
Внешняя сторона спиральной молекулы образована чередующимися остатками дезоксирибозы и фосфатными группами. Азотистые основания находятся внутри спирали. Структура спирали такова, что входящие в её состав полинуклеотидные цепи могут быть разделены только после раскручивания спирали.
Диаметр двойной спирали ДНК составляет 2 нм (нанометра), шаг общей спирали, на который приходится 10 пар нуклеотидов, — 3,4 нм.
Между аденином и тимином всегда возникают две, а между гуанином и цитозином — три водородные связи. В связи с этим обнаруживается важная закономерность: против аденина одной цепи всегда располагается тимин другой цепи, против гуанина — цитозин и наоборот.
Таким образом, пары нуклеотидов аденин и тимин, а также гуанин и цитозин строго соответствуют друг другу и являются дополнительными (пространственное взаимное соответствие), или комплементарными (от лат. complementum — дополнение).
Комплементарностью называют способность нуклеотидов к избирательному соединению друг с другом.
Комплементарность обеспечивается взаимодополнением пространственных конфигураций молекул азотистых оснований, а также количеством водородных связей, возникающих между азотистыми основаниями.
Состав молекулы ДНК был известен задолго до открытия её структуры. В 1950 году американский биохимик Эрвин Чаргафф, обследовав огромное количество образцов тканей и органов различных организмов, выявил следующующие закономерности, названные впоследствии правилами Чаргаффа.
Первое правило. Количество адениловых нуклеотидов в молекуле ДНК равно количеству тимидиловых, а количество гуаниловых — количеству цитидиловых. Второе правило. Количество пуриновых азотистых оснований равно количеству пиримидиновых. Третье правило Чаргаффа. Суммарное количество адениловых и цитидиловых нуклеотидов равно суммарному количеству тимидиловых и гуаниловых нуклеотидов, что следует из первого правила.
Зная последовательность расположения нуклеотидов в одной цепи ДНК по принципу комплементарности, можно установить нуклеотиды другой цепи.
Фрагмент одной цепи ДНК имеет следующий состав: А—А—Г—Г—Ц—Ц—Ц—Т—Т—. Используя принцип комплементарности, достроим вторую цепь.
В отличие от ДНК, РНК образована не двумя, а одной полинуклеотидной цепочкой. Обычно эта цепочка значительно короче цепей ДНК.
Рибонуклеиновые кислоты также являются полимерами, мономерами которых служат рибонуклеотиды, образованные: остатком пятиуглеродного сахара — рибозы, остатком фосфорной кислоты и остатком одного из азотистых оснований. Три азотистых основания — аденин, гуанин и цитозин — такие же, как и у ДНК, а четвертым является урацил.
Генетический код
Как мы уже сказали, в состав нуклеотидов входят азотистые основаная.
У ДНК четыре разных азотистых основания: аденин (А), тимин (Т) гуанин (Г) и цитозин (Ц).
3 нуклеотида (триплет) кодируют 1 аминокислоту. А какую именно аминокислоту, можно понять по последовательности этих самых нуклеотидов.
Однако изначально информация с ДНК переписывается на информационную (матричную) РНК в виде триплетов — кодонов.
Определённые кодоны соответствуют определённым аминокислотам.
Однако, многим аминокислотам соответствует не один, а несколько различных триплетов — кодонов. Считается, что такое свойство генетического кода повышает надёжность хранения и передачи генетической информации при делении клеток.
Например, аминокислоте аланину соответствует 4 кадона. ГЦУ, ГЦЦ, ГЦА и ГЦГ
Первые два азотистых основания у всех триплетов одинаковы. Поэтому даже если произойдёт случайная ошибка в третьем нуклеотиде, то все равно это будет кодон аланина.
Важное свойство генетического кода — это специфичность. То есть один триплет будет обозначать только одну аминокислоту.
В последовательности нуклеотидов молекулы ДНК закодирована информация о первичной структуре белка.

 Получите свидетельство
Получите свидетельство Вход
Вход




 1570
1570

