К щелочным металлам относятся металлы IA группы: Li, Na, K, Rb, Cs, Fr. Электронная схема внешнего электронного слоя для этих металлов ns1, где n – номер электронного слоя. То есть на внешнем электронном слое у них 1 электрон. Поэтому их степень окисления в соединениях +1.
По группе от лития до цезия увеличивается радиус атома, энергия ионизации и электроотрицательность уменьшаются. Среди металлов IA группы только Cs жёлтый, все остальные – серебристо-белые. Эти металлы мягкие и легко режутся ножом. У них низкая температура плавления. Из-за высокой химической активности щелочных металлов их хранят под изолирующим от атмосферы слоем керосина.
Основными соединениями металлов IA группы являются каменная соль, или галит (NaCl), мирабилит, или глауберова соль (Na2SO4 ∙ 10H2O), криолит (Na3AlF6), сильвин (KCl), сильвинит (KCl ∙ NaCl), карналлит (KCl ∙ MgCl2 ∙ 6H2O).
Натрий и калий являются жизненно важными элементами. В тканях млекопитающих действует система транспорта ионов натрия или калия, который называется калий-натриевый насос.
К металлам IIA группы относятся Be, Mg и щелочноземельные металлы Ca, Sr, Ba, Ra. Электронная схема внешнего электронного слоя для этих металлов ns2, где n – номер электронного слоя. То есть на внешнем электронном слое у них 2 электрона. Поэтому их степень окисления в соединениях +2.
По группе от бериллия до бария увеличивается радиус атома, энергия ионизации и электроотрицательность уменьшаются. Все металлы IIA группы являются серебристо-белыми. Бериллий – твёрдый, но хрупкий. Магний и щелочно-земельные металлы относительно мягкие, хот и более твёрдые, чем щелочные металлы.
Основными соединениями металлов IIA группы являются доломит (CaCO3 ∙ MgCO3), берилл (Be3Al2(SiO3)6), карналлит (KCl ∙ MgCl2 ∙ 6H2O), апатит (Ca3(PO4)2), барит (BaSO4), флюорит (CaF2).
Ионы кальция и магния находятся в биологических жидкостях всех живых организмах. Организм взрослого человека содержит приблизительно 1 кг кальция, а магний входит в состав зелёного пигмента растений – хлорофилла.
Металлы IA и IIA химически очень активные, особенно щелочные металлы. В реакции с кислородом литий и элементы IIA группы дают оксиды. Натрий в реакции с кислородом образует пероксид, а все остальные металлы IA группы – надпероксиды:
2Ba + O2 = 2BaO
2Na + O2 = Na2O2
K + O2 = KO2.
Магниевая лента горит в атмосфере углекислого газа, связывая при этом кислород. Именно поэтому горящий магний нельзя тушить, используя углекислотный огнетушитель:
2Mg + CO2 = 2MgO + C.
Для того чтобы получить оксиды натрия или калия, необходимо нагреть смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствии кислорода:
2NaOH + 2Na = 2Na2O + H2↑
Na2O2 + 2Na = 2Na2O
KO2 + 3K = 2K2O.
Пероксиды и надпероксиды щелочных металлов интенсивно взаимодействуют с водой, образуя гидроксиды и пероксид водорода:
Na2O2 + 2H2O = 2NaOH + H2O2
2KO2 + 2H2O = 2KOH + H2O2 + O2↑.
Щелочные и щелочноземельные металлы в реакции с водородом образуют гидриды:
2Li + H2 = 2LiH
Ba + H2 = BaH2.
В реакциях с галогенами металлы IA и IIA группы образуют галогениды:
2K + Br2 = 2KBr
Ca + Cl2 = CaCl2.
Металлы А-групп реагируют с серой с образованием сульфидов:
2Na + S = Na2S
Mg + S = MgS.
Металлы IA и IIA групп реагируют с азотом и углеродом:
6Li + N2= 2Li3N
2Li + 2C = Li2C2.
Щелочные металлы растворяются в жидком аммиаке, а также реагируют с парами аммиака при нагревании, при этом образуются кристаллические амиды:
2Na + 2NH3 = 2NaNH2 + H2↑.
Амиды легко разлагаются водой с образованием щёлочи и аммиака:
KNH2 + H2O = KOH + NH3↑.
Амиды щелочных металлов проявляют свойства очень сильных оснований и вступают в реакции с веществами, проявляющими слабые кислотные свойства, такими как алкины. При этом образуются ацетилениды:
NaNH2 + HC ≡ CH → NaC ≡ CH + NH3↑.
Щелочные металлы реагируют со спиртами, образуя алкоголята:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑.
Щелочные и щелочноземельные металлы реагируют с водой при обычных условиях. Магний реагирует с водой при нагревании, бериллий не реагирует с водой:
2K + 2H2O = 2KOH + H2↑
Ba + 2H2O = Ba(OH)2 + H2↑
Mg + H2O = MgО + H2↑.
С горячей водой или парами воды магний превращается в оксид:
Mg + H2O = MgO + H2↑
С растворами кислот реагируют все металлы А-групп:
Ca + 2HCl = CaCl2 + H2↑
Mg + 2CH3COOH = (CH3COO)2Mg + H2↑.
Со щелочами из металлов IA и IIA групп реагирует только бериллий:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑.
Гидроксиды металлов IA группы – белые, расплывающиеся на влажном воздухе вещества, водные растворы которых являются сильными основаниями.
Из металлов I A группы разлагается только гидроксид лития. Гидроксиды металлов II A группы при нагревании разлагаются:
2LiOH = Li2O + H2O
Ca(OH)2 = CaO + H2O
Mg(OH)2 = MgO + H2O.
Гидроксиды щелочных металлов проявляют все свойства оснований: реагируют с кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
2LiOH + H2SO4 = Li2SO4 + 2H2O
2KOH + CO2 = K2CO3 + H2O
2KOH (тв.) + Al2O3 (тв.) = 2KAlO2 + H2O↑
NaOH + Al(OH)3 = Na[Al(OH)4].
Для получения гидроксидов щелочных металлов используют электрохимические методы. Например, гидроксид натрия получают электролизом концентрированного водного раствора поваренной соли:
2NaCl + 2H2O = 2NaOH + Cl2↑ (анод) + H2↑ (катод).
Все оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием соответствующих оснований. Оксиды бериллия является амфотерным, оксид магния с водой также не реагирует, так как гидроксид магния – слабое основание:
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2.
Оксиды щелочных и щелочноземельных металлов реагируют с кислотными оксидами и кислотами:
Li2O + 2HNO3 = 2LiNO3 + H2O
3CaO + P2O5 = Ca3(PO4)2.
Щелочные металлы и все их соединения окрашивают пламя в определённый цвет. Литий – в карминово-красный, натрий – в жёлтый, калий – в фиолетовый, кальций – в кирпично-красный цвет, стронций – красно-малиновое пламя, а барий – в травянисто-зелёное.

Получают щелочные металлы электролизом расплавов галогенидов:
2NaCl → 2Na (катод) + Cl2 (анод).
Бериллий получают восстановлением магнием из фторидов:
BeF2 + Mg = Be + MgF2.
Магний в основном получают из морской воды путём осаждения ионов магния в виде гидроксида, который потом переводят в хлорид. Затем хлорид магния обезвоживают и расплавляют, получая из расплава под действием электрического тока магний:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
MgCl2 = Mg + Cl2↑.
Магний можно получить, нагревая его оксид с углеродом:
MgO + C = Mg + CO
Для получения бария используют метод – алюмотермию:
3BaO + 2Al = Al2O3 + 3Ba.
Кальция и стронций получают электролизом расплавов хлоридов:
CaCl2 = Ca + Cl2↑.
Жёсткая вода – это вода, содержащая ионы Са2+ и Mg2+. Различают временную и постоянную жёсткость. Временная жёсткость обусловлена наличием в воде гидрокарбонатов кальция и магния. Устраняют временную жёсткость кипячением, действием соды, действием известкового молока, с помощью ионитов:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3
Ca(HCO3) + Ca(OH)2 = 2CaCO3↓ + 2H2O.
Постоянная жёсткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния. Устраняют постоянную жёсткость действием соды и с помощью ионитов:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4.
Кроме этого, жёсткость воды устраняют поташ, фосфаты натрия и калия, которые переводят ионы кальция и магния в осадок.

 Получите свидетельство
Получите свидетельство Вход
Вход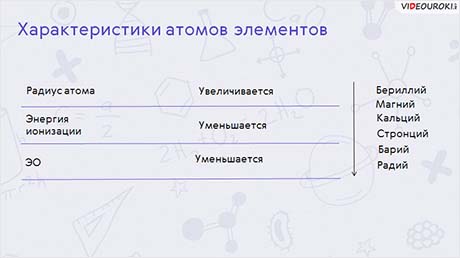




 1168
1168

