Мир химических реакций огромен и многообразен. Сущность химических реакций состоит в превращении одних веществ в другие. При этом разрушается структура исходных веществ за счёт разрыва химических связей и возникают новые вещества с новыми связями и другим строением. Каждая химическая реакция имеет свои характеристики.
Неорганические реакции классифицируют по нескольким признакам. По числу и составу исходных веществ и продуктов реакции можно выделить следующие типы химических реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.

Реакции соединения – это реакции, в ходе которых из двух или более веществ образуется одно сложное вещество.

Существует большое число реакций соединения простых веществ: например, железа и хлора с образованием хлорида железа три, водорода с хлором с образованием хлороводорода.

А также известно много реакций соединения сложных веществ: например, в результате взаимодействия оксида калия и воды образуется гидроксид калия, в реакции оксида магния и оксида серы шесть образуется сульфат магния, в реакции хлорида железа два с хлором образуется хлорид железа три.

Реакциями разложения называются реакции, в результате которых из одного сложного вещества образуются два или более новых веществ.

Так, в реакции разложения карбоната бария образуется оксид бария и углекислый газ, в реакции разложения нитрата серебра один образуется серебро, оксид азота четыре и кислород, в реакции разложения малахита образуется оксид меди два, углекислый газ и вода.
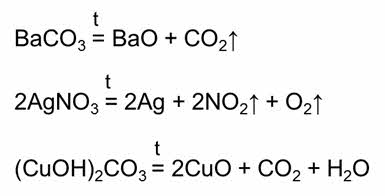
Реакции замещения – это реакции между простыми и сложными веществами, при протекании которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества.

Например, в реакции алюминия с оксидом железа три образуется железо и оксид алюминия, в реакции хлора с бромидом калия образуется хлорид калия и бром, в реакции карбоната кальция с оксидом кремния четыре образуется силикат кальция и углекислый газ.

Реакциями обмена называются реакции между двумя сложными веществами, которые обмениваются своими составными частыми.

Так, в реакции азотной кислоты с гидроксидом натрия образуется нитрат натрия и вода, в реакции хлорида бария с серной кислотой образуется сульфат бария и соляная кислота, в реакции карбоната натрия с соляной кислотой образуется хлорид натрия, углекислый газ и вода.

В результате реакций обмена обычно образуется осадок, газообразное вещество или слабый электролит.
По признаку изменения степеней окисления элементов в молекулах реагирующих веществ, все реакции делятся на: окислительно-восстановительные, которые идут с изменением степени окисления, и на реакции, идущие без изменения степени окисления.
Так, реакция разложения карбоната кальция до оксида кальция и оксида углерода четыре не является окислительно-восстановительной, так как элементы здесь не изменяют свои степени окисления.
А реакция меди с хлором является окислительно-восстановительной, потому что медь повышает свою степень окисления с нуля до плюс двух, а хлор понижает свою степень окисления с нуля до минус единицы. Медь является восстановителем, а хлор – окислителем.

По знаку теплового эффекта все реакции делятся на: экзотэрмические, идущие с выделением теплоты, и эндотермические, которые идут с поглощением теплоты.
Например, реакция образования хлороводорода из водорода и хлора является экзотэрмической, а реакция образования оксида азота два из азота и кислорода является эндотэрмической.

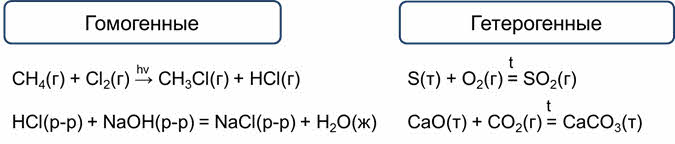
По признаку однородности реакционной системы различают реакции гомогенные, протекающие в однородной системе, и гетэрогенные, протекающие в неоднородной системе.
Например, реакция метана с хлором является гомогенной, потому что исходные вещества и продукт реакции находятся в одном агрегатном состоянии – газообразном.
Реакция соляной кислоты с гидроксидом натрия также является гомогенной, так как все вещества являются жидкостями.
А реакция серы с кислородом будет гетэрогенной, так как сера является твёрдым веществом, а кислород и сернистый газ – газообразными.
Реакция оксида кальция с оксидом углерода четыре также будет гетэрогенной, потому что оксид кальция и карбонат кальция являются твёрдыми веществами, а оксид углерода четыре – газом.
В зависимости от присутствия или отсутствия катализатора реакции делятся на: каталитические, которые идут с участием катализатора и некаталитические, идущие без участия катализатора.
Например, реакция образования оксида серы шесть из оксида серы четыре и кислорода является каталитической, так как эта реакция идёт в присутствии катализатора – оксида ванадия пять.
А реакция серной кислоты с гидроксидом натрия будет некаталитической, так как не требует участия катализатора.

По признаку обратимости все реакции делят на необратимые, которые идут только в одном направлении и на обратимые, которые идут одновременно в прямом и обратном направлении. Например, реакция образования аммиака из азота и водорода является обратимой, а реакция горения метана – необратимой.

В органической химии реакции классифицируют в зависимости от изменения строения реагирующих молекул и характера изменения связей. Кроме того, органические реакции имеют свои особенности.
Органические реакции идут медленно и требуют определённых условий: температура, давление, катализатор. Выход продуктов реакции невысокий, так как большинство реакций идёт в несколько стадий.

Cуществует несколько классификаций органических реакций.
Первая классификация по механизму реакции, то есть по разрыву ковалентной связи. Это гомолитические, или радикальные реакции, которые идут с образованием радикалов – частиц с неспаренным электроном. Их течение сопровождается гомолитическим разрывом связи.

Например, гомолотической реакцией является реакция хлорирования алканов, которая идёт по свободнорадикальному цепному механизму.
Гетэролитические, или ионные реакции протекают с образованием катиона и аниона. Гетэролитический разрыв ковалентной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов).
В зависимости от природы атакующего реагента реакции могут быть нуклеофильными и электрофильными.
Нуклеофильными являются реакции, где реагентом является нуклеофил, то есть анион или молекула, которые предоставляют свою пару электронов на образование новой связи.
Например, в реакции хлорметана с с гидроксидом натрия гидроксид натрия выступает в роли нуклеофильного реагента.
Электрофильными называются реакии с электрофильными реагентами (электрофилами), то есть катионами или молекулами, которые имеют свободную орбиталь, которая может принять электроны для образования новой связи.

Так, в реакции этилена с хлороводородом электрофилом является катион водорода в составе хлороводорода.
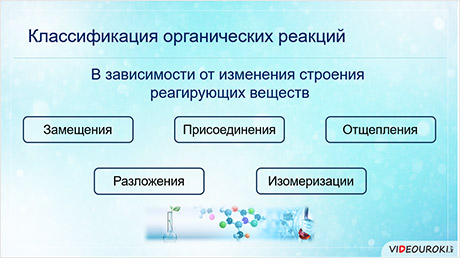
В зависимости от изменения строения реагирующих веществ реакции разделяют на реакции замещения, присоединения, отщепления, разложения и изомеризации.
В реакциях замещения атом или группа атомов в исходной молекуле замещается на атом или группу атомов.
Например, в реакции хлорирования метана, атом хлора замещает один атом водорода в молекуле метана, при этом образуется хлорметан и хлороводород. В реакции бензола с хлором в присутствии катализатора, атом хлора также замещает один атом водорода в молекуле бензола и образуется бромбензол и хлороводород. Реакции замещения характерны для алканов, ароматических соединений, спиртов, фенолов, карбоновых кислот, углеводов.

В реакциях присоединения происходит разрыв пи-связей и присоединение к атомам углерода и гетэроатомам фрагментов реагентов.
Например, в реакции пропэна с бромом разрывается пи-связь в молекуле пропэна и к каждому атому углерода при двойной связи присоединяется атом брома. В данной реакции образуется один-два-дибромпропан. В реакции бутаналя с водородом в молекуле бутаналя также разрывается пи-связь, по месту разрыва этой связи присоединяется водород, при этом образуется бутанол-один.

Таким образом, реакции присоединения характерны для углеводородов с кратными связями, альдэгидов, кетонов, моносахаридов, при определённых условиях эти реакции характерны и для ароматических соединений.
Реакции отщепления характерны для галогенуглеводородов и спиртов. Так, в реакции один-бромбутана со спиртовым раствором щёлочи образуется бромид натрия, вода и бутэн-два. При отщеплении воды от молекулы этанола образуется этэн.

В ходе реакций разложения из одного органического вещества образуются новые вещества. Например, при тэрмическом крекинге бутана образуется этан и этэн. Таким образом, разорвались углеро-углеродные связи и образовался алкан и алкен.

Реакциями изомеризации называются реакции превращения данного органического вещества в его изомер. Например, в реакции изомеризации пентана образуется его изомер – два-метилбутан.

Особым видом органических реакций являются реакции полимеризации и реакции поликондэнсации. Так, в реакции полимеризации этилена образуется полиэтилен.
В реакции полимеризации стирола – полистирол.

В реакции поликондэнсации шесть-аминогексановой кислоты образуется капрон и низкомолекулярное вещество – вода. Примером реакции поликонденсации служит также реакция получения крахмала из глюкозы.

С участием кислорода или водорода проходят реакции окисления и восстановления. При этом происходит изменение степеней окисления. Так, при окислении этаналя гидроксидом меди два образуется этановая кислота. При этом степень окисления углерода меняется от плюс единицы до плюс трёх. При восстановлении уксусного альдэгида в присутствии никелевого катализатора образуется спирт – этанол. Степень окисления углерода изменяется с плюс единицы до минус единицы.
Таким образом, классифицировать химические реакции можно по различным признакам. Химические реакции сопровождаются разрывом одних связей и образованием других связей.

 Получите свидетельство
Получите свидетельство Вход
Вход




 8398
8398

