Гидролиз солей — это реакция взаимодействия ионов соли с Н+ и ОН− ионами воды, которая ведет к распаду исходного соединения.
Рассмотрим процессы, протекающие в водных растворах солей. Гидролизу подвергаются соли, образованные слабыми кислотами или слабыми основаниями, или тем и другим.
Если соль образована сильным основанием и слабой кислотой, то гидролиз идёт по аниону. Так, ацетат натрия в водном растворе диссоциирует на катион натрия и ацетат-ион:
CH3COONa → CH3COO- + Na+.
Затем остаток слабой кислоты частично реагирует с водой, забирая у неё ион водорода, при этом остаются в растворе гидроксид-ионы:
CH3COO- + HOH ↔ CH3COOH + OH-.
То есть в результате гидролиза ацетата натрия образуется уксусная кислота и гидроксид натрия, из гидроксид-ионов и катионов натрия:
CH3COONa + H2O ↔ CH3COOH + NaOH.
При растворении солей многоосновных кислот гидролиз протекает ступенчато, но по второй ступени значительно слабее, чем по первой.
Например, при гидролизе сульфида натрия гидролиз также идёт по аниону:
S2- + HOH ↔ HS- + OH-.
Причём преимущественно по первой ступени:
Na2S + H2O ↔ NaHS + NaOH.
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза. Гидролиз в этом случае обратим, то есть протекает не до конца. Чем слабее кислота, тем сильнее гидролиз соли этой кислоты.
Если соль образована слабым основанием и сильной кислотой, то гидролиз идёт по катиону. Например, при гидролизе хлорида железа (II) эта соль диссоциирует на катион железа и хлорид-ион:
FeCl2 → Fe2+ + 2Cl-
Ионы железа частично реагируют с водой, стараясь отнять у неё гидроксид-ионы, при этом в растворе остаются ионы водорода, которые соединяются с хлорид-ионами до образования соляной кислоты. В итоге образуется гидроксохлорид железа (II) и соляная кислота:
Fe2+ + HOH ↔ Fe(OH)+ + H+
FeCl2 + HOH ↔ Fe(OH)Cl + HCl.
Гидролиз по второй ступени протекает значительно слабее, чем по первой. Гидролиз является в данном случае обратимым, то есть протекает не до конца. Чем слабее основание, тем сильнее гидролиз соли этого основания.
Соли, образованные слабым основанием и слабой кислотой, гидролизуются полностью, в результате образуется слабая кислота и слабое основание. Но реакция среды здесь зависит от силы кислоты и основания. К таким солям относится сульфид алюминия:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Если соль образована сильным основанием и сильной кислотой, то она не гидролизуется, так как ионы металла и кислотного остатка с водой не реагируют. Растворы этих солей имеют нейтральную среду. К таким солям относится, например NaCl.
Следует запомнить, что гидролизу подвергаются только растворимые соли. Например, карбонат бария образован слабой кислотой, но не гидролизуется, потому что плохо растворим в воде.
Таким образом, гидролизу не подвергаются такие соли, как KNO3, BaI2, LiBr и другие, так как они образованы сильным основанием и сильной кислотой.
Гидролиз по аниону идёт у таких солей, как KF, CH3COOLi, Ba(NO2)2, так как они образованы сильным основанием и слабой кислотой.
Гидролиз по катиону идёт у таких солей, как CuSO4, AlCl3, NH4NO3, так как они образованы слабым основанием и сильной кислотой.
Гидролиз идёт до конца: и по катиону, и по аниону у таких солей, как ZnF2, (NH4)2CO3, (CH3COO)2Pb.
Таким образом, в растворах таких солей, KF, CH3COOLi, Ba(NO2)2 среда щелочная, потому что соли образованы сильным основанием и слабой кислотой. В растворах таких солей, как CuSO4, AlCl3, NH4NO3 среда будет кислая, эти соли образованы слабым основанием и сильной кислотой. А в растворах таких солей, как KNO3, BaI2, LiBr среда раствора будет нейтральная, так как эти соли не подвергаются гидролизу, они образованы сильным основанием и сильной кислотой.
Водородный показатель рН численная характеристика кислотной или щелочной среды водного раствора. Численно рН равен отрицательному показателю молярной концентрации ионов Н+.
То есть если c(H+) = 10-1, pH = - (-1) = 1, c(H+) = 10-2, pH = - (-2) = 2, c(H+) = 10-3, pH = - (-3) = 3. В нейтральных растворах рН = 7, в кислых растворах рН < 7, в щелочных рН > 7. Чем меньше рН, тем больше концентрация ионов водорода и тем более кислой является среда. Чем больше рН, тем больше концентрация гидроксид-ионов, тем более щелочной является среда.
Характер среды устанавливается с помощью индикаторов: лакмуса, метилоранжа, фенолфталеина. Лакмус и метилоранж в кислой среде имеет красную окраску, в щелочной среде лакмус – синий, метилоранж – жёлтый, а фенолфталеин – малиновый.
Так, водные растворы NaOH, NH3, CH3NH2 имеют рН > 7, а водные растворы HCl, SO2, H2SO4 имеют рН < 7. В первом случае лакмус будет иметь синюю окраску, а во втором – красную.
Таким образом, если соль образована сильным основанием и слабой кислотой, то гидролиз идёт по аниону, реакция среды будет щелочная – рН > 7; если соль образована слабым основанием и сильной кислотой, то гидролиз идёт по катиону, реакция среды будет кислая, рН < 7; если соль образована сильным основанием и сильной кислотой, то гидролиз не идёт, реакция среды будет нейтральной, рН = 7.

Решим задачи.
Определите массу серной кислоты в растворе объёмом 10 л, если рН раствора серной кислоты равен 4.

В 500 мл воды растворили 1,12 л (н. у.) хлороводорода. Пренебрегая изменением объёма, укажите рН полученного раствора.

Смешали раствор гидроксида бария и соляную кислоту. После чего молярная концентрация анионов в образовавшемся растворе составила 0,3 моль/л, а рН равен 1. Определите молярную концентрацию соли в образовавшемся растворе, если учесть, что растворённые вещества диссоциируют полностью.


 Получите свидетельство
Получите свидетельство Вход
Вход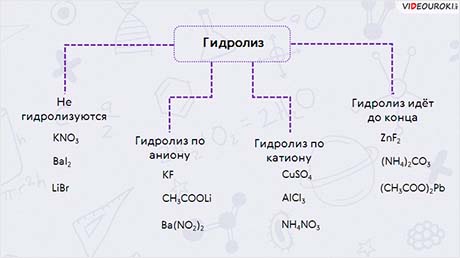




 2120
2120

