В образовании ковалентных связей принимают участие как эс-, так и пэ-электроны, орбитали которых имеют различную форму и направленность в пространстве.
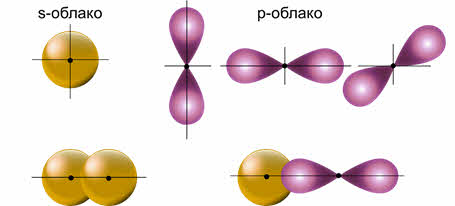
Связи, которые образуются между ними, являются равноценными и расположены симметрично.
Это явление объясняется на основе концепции гибридизации атомных валентных орбиталей. Согласно концепции, в образовании химической связи принимают участие гибридные орбитали, то есть это орбитали, усреднённые по форме и размерам, а, следовательно, и по энергии. Число гибридных орбиталей равно числу исходных.

Гибридные орбитали более вытянуты в пространстве, а это обеспечивает их более полное перекрывание с орбиталями соседних атомов.
Из-за своей симметрии гибридные орбитали не участвуют в образовании пи-связи, так как не могут обеспечить перекрывание между собой в двух областях пространства.

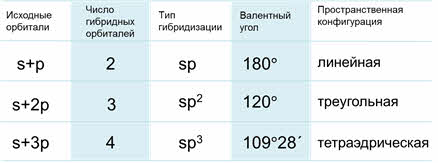
Основными условиями устойчивой гибридизации являются:
Первое, в гибридизации могут участвовать орбитали с близкими значениями энергий, то есть эс-, пэ-орбитали внешнего энергетического уровня и дэ-орбитали внешнего или предвнешнего уровня;
второе, гибридная атомная орбиталь должна более плотно перекрываться с орбиталями другого атома при образовании связи;
третье, в гибридизации участвуют орбитали с достаточно высокой электронной плотностью, которыми в большинстве случаев являются орбитали элементов начальных периодов;
четвёртое, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга.
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы. При комбинации одной эс- и одной пэ-орбитали возникает две эс-пэ-гибридные орбитали, расположенные симметрично под углом сто восемьдесят градусов.
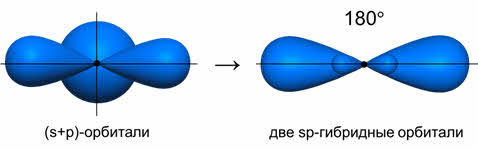
Связи, образованные с участием электронов этих орбиталей, также располагаются под углом сто восемьдесят градусов.
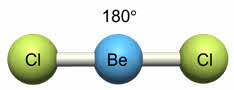
Например, у атома бериллия эс-пэ-гибридизация орбиталей проявляется в молекуле хлорида бериллия, которая вследствие этого имеет линейную форму.
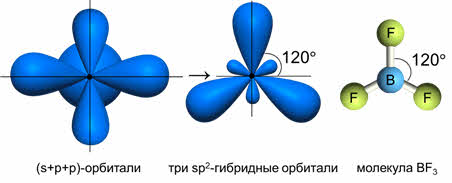
Комбинация трёх орбиталей (одной эс- и двух пэ-орбиталей) приводит к образованию трёх эс-пэ-два гибридных орбиталей, расположенных под углом сто двадцать градусов, как в молекуле фторида бора.
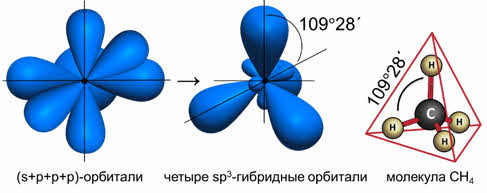
Комбинация четырёх орбиталей (одной эс- и трёх пэ-типа) приводит к эс-пэ-три гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырём вершинам тэтраэдра, то есть под углом сто девять градусов двадцать восемь минут, как в атоме углерода в молекуле метана.
Таким образом, если исходными орбиталями являются эс- и пэ-, то образуется две гибридные орбитали, возникает гибридизация эс-пэ типа, связи при этом расположены под углом сто восемьдесят градусов, в пространстве молекула имеет линейное строение.
Если исходные орбитали одна эс и две пэ-орбитали, то образуется три гибридных орбитали, тип гибридизации при этом эс-пэ-два, валентный угол равен сто двадцать градусов, а форма молекулы треугольная.
Если в гибридизации участвуют одна эс и три пэ-орбитали
то образуется четыре гибридных орбитали, возникает эс-пэ-три гибридизация, валентный угол при этом сто девять градусов двадцать восемь минут, а форма молекулы тэтраэдрическая.
Основные характеристики разных типов гибридизации
Пространственное строение молекул или ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизированных орбиталей.
Часто в молекулах углы между связями отличаются от углов, соответствующих типу гибридизации. Почему же так происходит?
Во-первых, геометрическая конфигурация молекул определяется в основном пространственной направленностью сигма-связей. Устойчивому состоянию молекулы соответствует такое пространственное расположение электронных облаков валентного слоя, при котором их взаимное отталкивание минимально. Поэтому такие электронные пары стремятся максимально оттолкнуться друг от друга, располагаясь в пространстве под возможно большим углом.
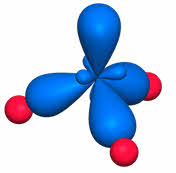
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации являются:
во-первых, не все гибридные орбитали участвуют в образовании связей, часть из них – несвязывающие. Электронные пары, находящиеся на этих орбиталях, называются несвязывающими, или неподелёнными. Так, в молекуле аммиака у атома азота одна пара электронов – не связывающая, в молекуле воды у атома кислорода две пары электронов являются несвязывающими.
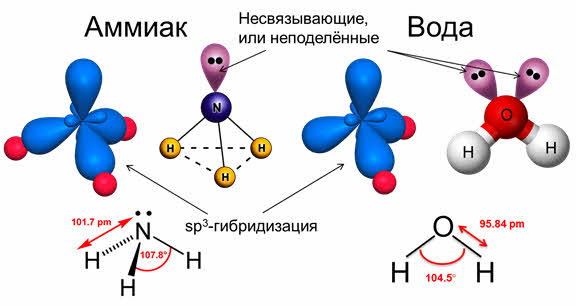
Связывающая электронная пара локализована между атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Поэтому отталкивающее действие несвязывающей пары проявляется в большей мере, чем связывающей. В молекуле воды и аммиака у атомов азота, и кислорода один и тот же тип гибридизации атомных орбиталей – эс-пэ-три. Однако из-за наличия одной у азота и двух у кислорода несвязывающих пар электронов идеальный угол для этого типа гибридизации, равный сто девять градусов двадцать восемь минут, уменьшается до ста семи градусов у аммиака и ста четырёх с половиной у воды.
Второй причиной отклонений углов связей является наличие пи-связей, которые влияют на величину валентного угла, но это не сказывается на типе гибридизации и геометрии молекулы.
Предполагают, что электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи занимает больший объём пространства, чем одинарной и поэтому обладает большим отталкивающим действием.
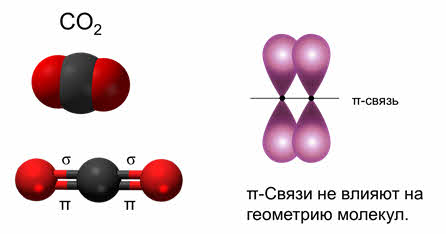
Так, в молекуле углекислого газа две ковалентные связи одинарные, так как являются сигма-связями, а две другие связи – это пи-связи. Пи-связи не влияют на геометрию молекул, поэтому в пространстве молекула углекислого газа имеет линейное строение, и здесь эс-пэ-тип гибридизации.
Виды геометрических конфигураций
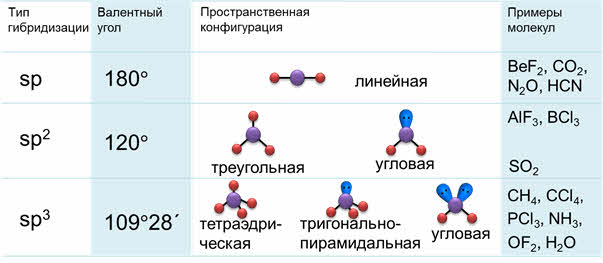
Молекулы с эс-пэ-гибридизацией имеют линейное строение. Валентный угол при этом сто восемьдесят градусов. К таким молекулам относятся фторид бериллия, молекула углекислого газа, оксида азота один, синильной кислоты.
В молекулах с эс-пэ-два-гибридизацией валентный угол сто двадцать градусов, форма молекулы может быть треугольной, как у фторида алюминия, хлорида бора, так и угловой, как у молекулы оксида серы четыре.
В молекулах с эс-пэ-три-гибридизацией валентный угол сто девять градусов двадцать восемь минут. Молекулы могут иметь тэтраэдрическое строение, как молекула метана, тэтрахлорметана, а также тригонально-пирамидальное строение, как у хлорида фосфора три, аммиака, или угловое строение, как у фторида кислорода и воды.
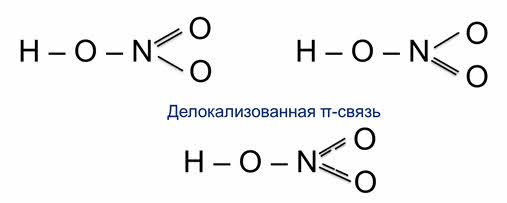
Иногда строение многих молекул нельзя изобразить такой одной графической формулой, потому что истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Так, строение молекулы азотной кислоты можно изобразить двумя равнозначными графическими формулами. Так как в этой молекуле два атома кислорода равноценны, строение молекулы лучше отражает графическая формула с дэлокализованной пи-связью. Пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями. Эта электронная пара принадлежит не двум, а трём атомам, поэтому образованная таким образом связь является трёхцентровой.
Многоцентровые связи
Таким образом, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. Гибридные орбитали участвуют в образовании только сигма-связи.
Геометрия любой молекулы определяется пространственной направленностью сигма-связью. На пространственное строение молекулы оказывают влияние несвязывающие пары электронов, которые уменьшают углы связей между сигма-связями.

 Получите свидетельство
Получите свидетельство Вход
Вход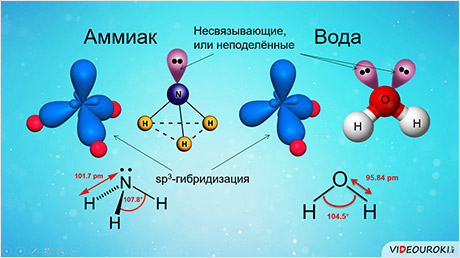




 10975
10975

