Основания делят на две группы: щёлочи – растворимые в воде основания и нерастворимые в воде. Щёлочи представляют собой гидроксиды щелочных и щелочноземельных металлов, нерастворимые основания – это слабые гидроксиды щелочных и щелочноземельных металлов. К щелочам относятся: NaOH, KOH, Ba(OH)2, Ca(OH)2. К нерастворимым в воде основаниям относятся: Mg(OH)2, Cu(OH)2, Fe(OH)2, Cr(OH)2. Нерастворимыми в воде являются также амфотерные гидроксиды. Такие, как Be(OH)2, Zn(OH)2, Al(OH)3, Fe(OH)3.
Основные свойства проявляют также NH3 и амины, которые являются органическими основаниями.
Рассмотрим химические свойства оснований. Например, щёлочи при растворении в воде почти полностью распадаются на ионы. Так, при диссоциации NaOH → Na+ + OH-, в большом количестве образуются гидроксид-ионы, которые изменяют окраску индикаторов. Лакмус становится синим, метилоранж – жёлтым, а фенолфталеин – малиновым.
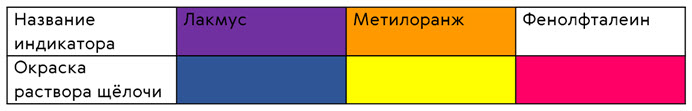
Нерастворимые в воде основания, а также амфотерные гидроксиды не изменяют окраску индикаторов, так как в их растворах малая концентрация гидроксид-ионов.
С кислотными оксидами реагируют щёлочи. А амфотерные гидроксиды реагируют как с кислотными, так и с основными оксидами. Кроме того Нерастворимые в воде основания реагируют с некоторыми кислотными оксидами:
2KOH + CO2 = K2CO3 + H2O
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Zn(OH)2 + K2O = K2ZnO2 + H2O.
С сильными кислотами реагируют все без исключения основания, а для слабых оснований реакции со слабыми кислотами менее характерны. Например:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2 + 6H2O
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
Амфотерные гидроксиды реагируют с расплавами и водными растворами щелочей. Например:
Al(OH)3 + KOH = K[Al(OH)4]
Al(OH)3 + KOH (тв.) = KAlO2 + 2H2O
Zn(OH)2 + 2NaOH (р-р) = Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH (тв.) = Na2ZnO2 + 2H2O.
С солями реагируют только щёлочи и только, если исходная соль растворима и если продуктом является осадок:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
MgCl2 + 2KOH = Mg(OH)2↓ + 2KCl.
Амфотерные гидроксиды при сплавлении реагируют с карбонатами:
2Al(OH)3 + Na2CO3 = 2NaAlO2 + CO2↑ + 3H2O.
Следует запомнить, что при нагревании не разлагаются NaOH, KOH, CsOH, RbOH. Все остальные гидроксиды при нагревании разлагаются на оксид и воду:
2LiOH = Li2O + H2O
Mg(OH)2 = MgO + H2O
2Al(OH)3 = Al2O3 + 3H2O
Zn(OH)2 = ZnO + H2O.
Щёлочи также реагируют с некоторыми металлами, как Zn, Be, Al, а также и неметаллами. Например, такими, как P, Cl2, S:
2KOH + Cl2 = KCl + KClO + H2O
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑.
Соли бывают средними (CuCl2), кислыми (KHSO4), основными (Mg(OH)NO3), комплексными (K[Al(OH)4], двойными (KAlSO4) и смешанными (Ca(OCl)Cl).
Рассмотрим химические свойства средних солей. Так, растворы солей диссоциируют на ионы металла и ионы кислотного остатка:
Al2(SO4)3 → 2Al3+ + 3SO42-.
Средние соли реагируют с металлами, причём более активный металл вытесняет из раствора соли менее активный. Это правило не работает в случае щелочных и щелочноземельных металлов.
Fe + CuCl2 = FeCl2 + Cu↓.
С карбонатами реагируют SiO2, амфотерные оксиды и гидроксиды:
MgCO3 + SiO2 = MgSiO3 + CO2↑
K2CO3 + Al2O3 = 2KAlO2 + CO2↑.
С солями реагируют щёлочи, а также кислоты. Например:
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Соли также реагируют с солями. При этом в реакцию должны вступать две растворимые соли и образовываться только одна нерастворимая:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl.
Рассмотрим отношение к нагреванию некоторых солей. Карбонаты многих металлов и аммония при нагревании разлагаются. Например:
BaCO3 = BaO + CO2↑
(NH4)2CO3 = 2NH3↑ + CO2↑ + H2O.
Гидрокарбонаты легко разлагаются при нагревании:
2KHCO3 = K2CO3 + CO2↑ + H2O
NH4HCO3 = NH3↑ + CO2↑ + H2O.
Характер продуктов разложения нитратов зависит от природы катионы. Так, при разложении нитратов металлов от Cs до Mg, образуются нитриты металлов и кислород, при разложении нитратов металлов от Mg до Cu, а также Li, образуются оксиды металлов, оксид азота (IV) и вода. Если металл от Hg до Au, то при разложении его нитрата образуется металл, оксид азота (IV) и вода.
Следует запомнить также и некоторые особенные случаи разложения солей:
2KMnO4 = K2MnO4 + MnO2 + O2↑
2KClO3 = 2KCl + 3O2↑
NH4NO3 = N2O↑ + 2H2O
NH4NO2 = N2↑ + 2H2O.
Кислые же соли реагируют со щелочами, при этом образуются средние соли или менее «кислые» соли:
KHCO3 + KOH = K2CO3
NaH2PO4 + NaOH = Na2HPO4 + H2O.
Кислые соли слабых кислот взаимодействуют с более сильными кислотами:
NaHCO3 + HCl = NaCl + CO2↑ + H2O.
А также кислые соли могут вступать в реакции обмена с другими солями:
Ca(HCO3)2 + Na2CO3 = CaCO3↓ + NaHCO3.
Рассмотрим способы получения оснований и солей. Щёлочи можно получить в реакциях металла с водой:
2Na + 2H2O = 2NaOH + H2↑.
А также в реакциях основного оксида с водой и гидрида с водой:
BaO + H2O = Ba(OH)2
KH + H2O = KOH + H2↑.
Щёлочи можно получить в реакциях соли со щёлочью, а также в результате электролиза водных растворов солей:
Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH
2NaCl + H2O = 2NaOH + H2↑ + Cl2↑.
Нерастворимые основания и амфотерные гидроксиды получают в результате взаимодействия соли со щелочью или NH3 ∙ H2O:
AlCl3 + 3NH3 ∙ H2O = Al(OH)3↓ + 3NH4Cl
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4.
Существует несколько способов получения солей. Так, средние соли можно получить по реакции металла с неметаллом, в реакциях основных оксидов с кислотами, основных оксидов с кислотными оксидами, кислотных оксидов со щелочами:
2Fe + 3Cl2 = 2FeCl3
Na2O + H2SO4 = Na2SO4 + H2O
CaO + CO2 = CaCO3
SO2 + 2KOH = K2SO3 + H2O.
Кроме этого, соли получают в реакциях кислот с основаниями, кислот с солями, солей с солями, солей с металлами, а также кислот с металлами:
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O
2HCl + Na2SO3 = 2NaCl + H2O + SO2↑
K2CO3 + MgSO4 = K2SO4 + MgCO3↓
Zn + FeSO4 = ZnSO4 + Fe
Mg + 2HCl = MgCl2 + H2↑.
Соли можно получить по реакции кислых солей со щёлочью, кислых солей с кислотами, при нагревании некоторых солей, а также в реакциях взаимодействия амфотерных оксидов с основными оксидами, кислотными оксидами, карбонатами и щелочами:
KHCO3 + KOH = K2CO3 + H2O
NaHCO3 + HNO3 = NaNO3 + CO2↑ + H2O
2KNO3 = 2KNO2 + O2↑
Al2O3 + K2O = 2KAlO2.

 Получите свидетельство
Получите свидетельство Вход
Вход




 1849
1849