Форма учебной работы: классно-урочная.
Тип урока: урок изучения и первичного закрепления новых знаний. (комбинированный урок).
Дидактические цели:
Ввести понятие изопроцесса;
Изучить газовые законы;
Научиться применять законы
Решать количественные и качественные задачи по данной теме
Задачи урока:
Образовательные:
Изучить изопроцессы (история открытия, модель установки для изучения зависимостей между термодинамическими параметрами, графики изопроцесса, математическая запись закона, объяснение с точки зрения МКТ);
Научить учащихся решать аналитические и графические задачи, используя уравнение состояния и газовые законы.
Воспитательные:
Продолжить формирование познавательного интереса учащихся;
В целях интернационального воспитания обратить внимание учащихся, что физика развивается благодаря работам ученых разных стран и исторических времён;
Продолжить формирование стремления к глубокому усвоению теоретических знаний через решение задач.
Развивающие:
Для развития мышления учащихся продолжить отработку умственных операций анализа, сравнения и синтеза;
Осуществляя проблемно-поисковый метод самостоятельно получить из уравнения состояния Менделеева –Клапейрона газовые законы для изо процессов;
Научить применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач.
Оборудование: ПК, мультимедийная установка, презентация к уроку, интерактивная доска.
Дидактические материалы: задачи, формулы.
Ход урока
І. Мотивационный этап.
На прошлом уроке, мы получили уравнение состояния идеального газа. И теперь зная это уравнение можно вывести все три газовых закона на сегодняшнем уроке. Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200лет.
Сегодня мы попробуем самостоятельно получить формулировки газовых законов.
По сравнению с 17-18 в. для вас эта задача значительно упрощена. Выступая в роли исследователей, вам самим придётся анализировать увиденное, делать выводы, объяснять результаты. Итак, на сегодняшнем уроке мы выясним: Понятие «Изопроцессы», Виды Изопроцессов, Газовые законы, Графические представления газовых законов.
Прежде чем перейти к основному изучению данной темы поговорим немного об основных понятиях, которые потребуются для объяснения увиденного.
II. Актуализация знаний.
1. Фронтальный опрос
Как называется модель на которой рассматривают состояние газообразных тел. (идеальный газ)
Какими параметрами характеризуется состояние идеального газа. (давление, объём, температура)
Как называются эти параметры. (макроскопические)
Какое уравнение связывает между собой эти параметры. PV=(m/M)RT
Как создаётся давление? (число ударов молекул)
Как термодинамический параметр давление связан с микроскопическими параметрами? (основное уравнение МКТ)
Как объём связан с микроскопическими параметрами? (объём обратно пропорционален концентрации)
III. Изучение газовых законов.
- При изучении газовых законов нужно помнить что три физические величины (m‚ Μ‚R являются const)
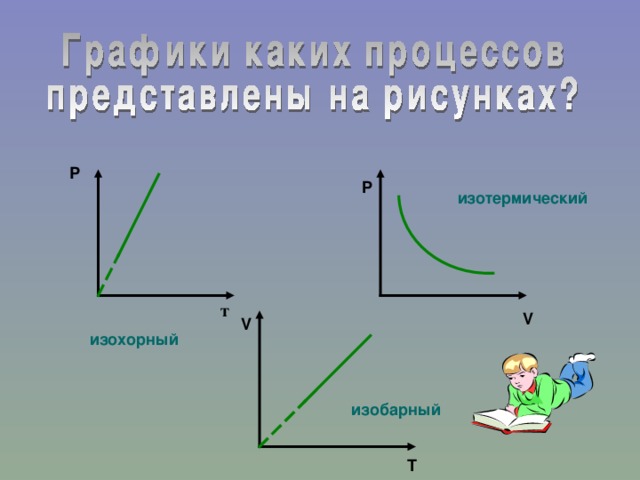
Газовые законы - количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Исходя из вышесказанного можно сказать, что существует три изопроцесса:
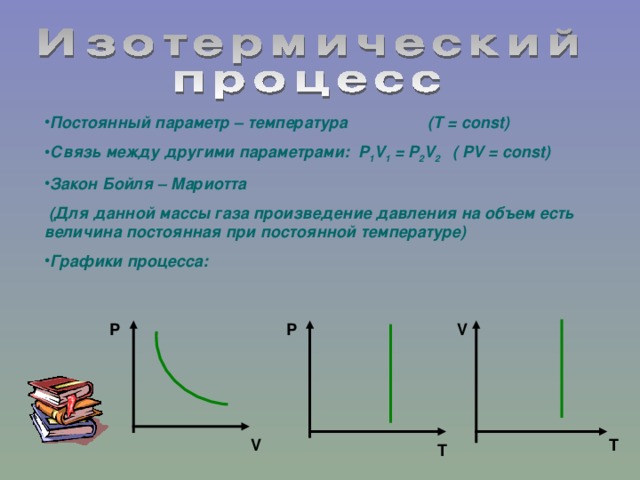
1. Изотермический процесс.
а) формула (P1 V1 = P2 V2 )
б) формулировка (Изотормическим процессом называются изменения состояния термодинамической системы, протекающие при постоянной температуре)
в) история открытия закона (Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1660 году и французским физиком Эдмоном Мариоттом в 1676 году)
Обращаем внимание на координатные оси.
Учитель объясняет как сравнивать изотермы при решении тестовых заданий или при решении графических задач.
2. Изобарный процесс.
История открытия (Закон установлен в 1802 году французским физиком Гей-Люссаком, который определяет объём газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально)
3. Изохорный процесс.
3.1Ученики самостоятельно делают вывод газового закона для изохорного процесса
а) формула
б) формулировка
в) история открытия (В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объёме и установил линейную зависимость давления от температуры, но не опубликовал исследование. Через 15 лет к таким же результатам пришёл и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.)
3.2.Выводы
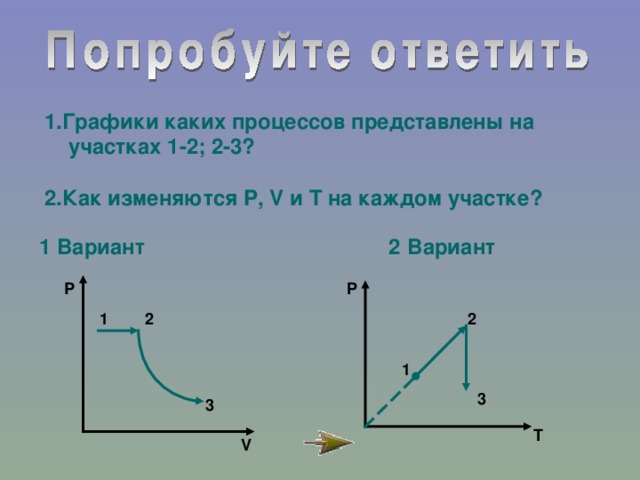
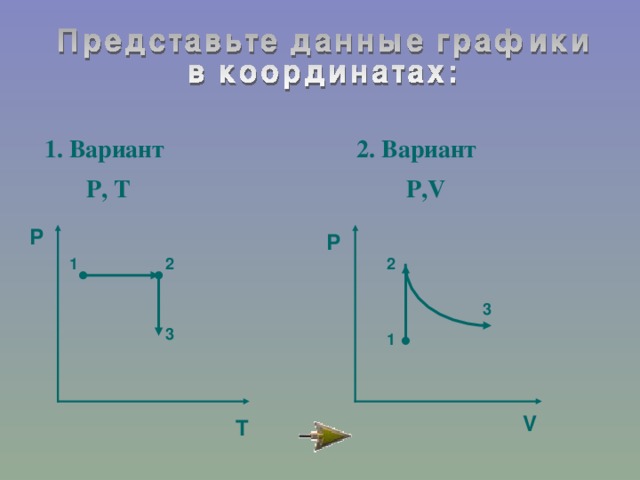
IV. Закрепление.
№154-161
V. Инструктаж домашнего задания
§71; упражнение 13 №1; Сборник задач Рымкевич №527; №536

 Получите свидетельство
Получите свидетельство Вход
Вход





















 Урок с презинтацией по теме: "Изопроцессы газовых законов" (91.44 KB)
Урок с презинтацией по теме: "Изопроцессы газовых законов" (91.44 KB)
 0
0 958
958 104
104 Нравится
0
Нравится
0


