Тема. Водород, его общая характеристика и нахожде-ние в природе. Получение водорода и его физические свойства
Цели: Изучить нахождение водорода в природе, сформировать представление о способах получения и собирания водорода в лаборатории и промышленности. Познакомить обучающихся с историей открытия водорода. Конкретизировать знания о химическом элементе и простом веществе на примере изучения водорода.
Задачи.
Образовательные: актуализировать знания учащихся о положении элемента водород в ПСХЭ; познакомить обучающихся с историей открытия водорода; охарактеризовать водород как химический элемент и простое вещество; дать понятие о способах получения водорода; закрепить умения применять полученные знания при объяснении новых фактов; продолжить формировать умения составлять формулы веществ.
Развивающие: развивать память и речь обучающихся; формировать
естественнонаучное мировоззрение; развивать умение работать в должном темпе, умение наблюдения; развивать познавательные умения(находить главное, вести конспект, наблюдать, делать выводы), поддерживать интерес к химии.
Воспитательные: воспитывать положительное отношение к занятиям, стремлению добиваться наилучших результатов, воспитывать дисциплинированность, эстетический вкус; воспитывать бережное отношение к природе; уважительное отношение к окружающим; умение слушать и понимать одноклассников.
.Планируемые результаты обучения
Предметные: повторить план характеристики элемента; получить знания о нахождении водорода в природе, способах получения водорода в лаборатории (реакцией замещения) и в промышленности; приобретают умения объяснять причину опасности работы с водородом; познакомить с историей открытия водорода. Знать состав молекулы водорода, соблюдать меры предосторожности при работе с химическими реактивами
Метапредметные: формирование умений: работать индивидуально и в паре; принимать участие в обсуждении темы; анализировать информацию.
Личностные: развивать умения слушать, рассуждать, вступать в диалог, строить высказывания, ставить вопросы по теме; учить самостоятельно искать информацию в книгах, использовать Интернет.
Основное содержание.
Нахождение водорода в природе, получение в лаборатории и промышленности. Характеристика водорода как простое вещество и химический элемент. История открытия водорода.
Деятельность обучающихся.
Повторить план характеристики химического элемента, простого вещества; научиться характеризовать водород как простое вещество и химический элемент; изучить устройство аппарата Кипа, сравнить собирание водорода методом вытеснения воздуха и методом вытеснения воды; охарактеризовать способы получения водорода в лаборатории и промышленности, познакомиться с нахождением водорода в природе, научиться составлять уравнения получения водорода.
Ценностный компонент урока: значимость умения давать характеристику элемента по плану; значимость умения характеризовать простое вещество по плану; показать взаимосвязь и отличие между получением водорода в аппарате Кипа и с помощью прибора для собирания газов и получением его в промышленности, значимость умения писать уравнения реакций.
Формы и методы: объяснительно-иллюстративный, фронтальный, наглядный, эксперимент, работа с книгой.
Межпредметные связи: астрономия биология
Оборудование: Презентация к интерактивной доске, аппарат Киппа, прибор для получения газов, цинк, соляная кислота, натрий и калий, кристаллизатор с водой, спиртовка и лучинка.
Тип урока: Урок изучения нового материала.
Ход урока
1. Организационный момент (подготовить учащихся к работе на уроке). Здравствуйте, ребята!
2. Повторение пройденного материала
(Слайд 1) В рамках повторения пройденного материала предлагаю выполнить несколько заданий
А) анаграмма ( оксид, горение, окисление)
Б) найти оксиды и дайте им названия(Слайд 2)
В-I : S, CuO, HCl, Fe, Na2O
В-II : HNO3 , ZnO, O3, SO3
В) составьте уравнения реакций(Слайд 3)
В-I
Fe + O2→ …
H2O2 → … + …
Al + Fe2O3 → … + …
В-II
HgO →….+ …..
H2 + O2 → ….
Fe + CuO → ….+……
3. Подготовка учащихся к активному и сознательному усвоению материала.
(Слайд 4) со стихотворением:
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!
(Слайд 5) Как вы думаете, о чем сегодня мы будем говорить? Учащиеся зачитывают данное стихотворение и называют тему урока “Водород” и записывают её в рабочие тетради.
(Слайд 6) План урока.
Водород в природе.
Историческая справка.
Водород – химический элемент.
Водород – простое вещество.
Получение и собирание водорода.
Физические свойства водорода.
Целеполагание учащимися после записи плана урока.
3. Этап усвоения новых знаний.
Учитель: переходим к изучению первого вопроса плана (Слайд 7)
Первый я на белом свете:
Во вселенной, на планете.
Превращаюсь в лёгкий гелий,
Зажигаю Солнце в небе.
Гость из космоса пришёл.
В воде приют себе нашёл!
(Объясните смысл стихотворения? О чем в нем говориться?)
Водород самый распространённый элемент в космосе. Основная масса звёзд состоит из водорода. В условиях звёздных температур и межзвёздного пространства это элемент существует в виде отдельных атомов. Водород входит в состав основного компонента Земли – вода. Хоть доля водорода в земной коре около 1% от массы, однако, его роль в природе определяется не массой, а числом атомов, доля которых 17%. Многие органические вещества представляют собой соединения С, О, Н: нефть, природный газ, углеводы, белки, жиры, нуклеиновые кислоты, витамины. В теле человека 10% атомов водорода.
| Водород - химический элемент.
| В земной коре (литосфера и гидросфера) – 1% по массе (10 место среди всех элементов) |
| АТМОСФЕРА - 0,0001% по числу атомов | |
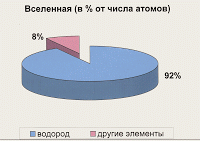
| Самый распространённый элемент во вселенной – 92% от числа всех атомов (основная составная часть звёзд и межзвёздного газа)
|
| Водород – химический элемент | В соединениях | Н2О – вода (11% по массе)
|
| СН4 – газ метан (25% по массе)
| ||
| Органические вещества (нефть, горючие природные газы и других) В организмах животных и растений (то есть в составе белков, нуклеиновых кислот, жиров, углеводов и других) В теле человека в среднем содержится около 7 килограммов водорода. |
(Слайд 8) Обратимся к истории Водород был открыт в первой половине ХVI века Парацельсом (он погружал железные опилки в серную кислоту). Водород получали также Ван - Гельмонт (1577-1644), Роберт Бойль (1627-1691), Михаил Васильевич Ломоносов (1711-1765), Джозеф Пристли и другие. (Слайд 9) В 1766 году известный английский ученый физик и химик Генри Кавендиш получил «искусственный воздух» действием кислоты на металл. Воздух Кавендиша оказался не видоизменением атмосферного воздуха, а совершенно самостоятельным веществом.
Он хорошо горел, поэтому его назвали «горючим воздухом». При горении «горючего воздуха» на стенках пробирки появлялись маленькие капельки воды. Результат поразил Кавендиша.
(Слайд 10) В 1783-1784 г Антуан Лавуазье совместно с Ж. Менье осуществили термическое разложение воды и установили, что она состоит из водорода и кислорода. Лавуазье включил водород в список химических элементов.
Свое название водород получил от того, что при горении давал не дым, сажу и копоть, а воду.
(Слайд 11) Французский химик, борон Л. Гитон де Морво в 1787 году дал современное название водороду. Он предложил латинское название «гидрогениум», означающее «рождающий воду».
Русское название по смыслу одно и тоже: вода род.
В середине 19 века в России утвердилось произношение символа элемента по-французски («аш»).
Мы узнали, почему водород получил такое название, а сейчас обратимся к периодической системе, где водород как химический элемент нашёл себе приют. Водород самый первый и самый лёгкий элемент.
(Слайд 12) Рассмотрим водород – как элемент и простое вещество.
порядковый номер №1
период 1
группа I (главная подгруппа «А»)
относительная масса Ar(Н)=1
относительная молекулярная масса Mr(H2)=2
молярная масса M(H2)=2г/моль
валентность
(Слайд 13) Внимательно прочитайте предложения и определите, в каком из них речь идёт о химическом элементе, а в каком о простом веществе.
1. Водород входит в состав воды и нефти.
2. Водородом наполняют воздушные шары.
3 . Водород – самый лёгкий из всех газов.
4. Водород в земной коре в % по массе занимает 9-е место.
Учащиеся работают устно, отвечают на вопрос и делают выводы, чем отличается простое вещество и химический элемент.
Какими же способами можно получить водород?
(Слайд 14) Получение водорода
В промышленности
Вплоть до конца XIX века получение водорода было делом достаточно хлопотным. Его добывали в мизерных количествах, растворяя обычные металлы в кислотах, а также щелочные и щелочноземельные металлы в воде. Только после того, как электричество начали производить в промышленных масштабах, появилась возможность легко добывать его тоннами.
Как вы думаете какое вещество является самым доступным источником водорода? Да, верно, вода – самый доступный источник водорода. В промышленности действительно водород получают из воды.
Но этот способ сравнительно дорогой. Т.к. из воды водород можно получить, только разложив его электрическим током.
Итак в промышленности в больших количествах водород получают из природного газа (в основном это метан) при взаимодействии его с парами воды при 800 °С в присутствии никелевого катализатора:
CH4 + 2H2O = 4H2 +CO2 (t, Ni)
или обрабатывают при высокой температуре парами воды уголь:
2H2O + С = 2H2 + CO2 (t)
Чистый водород получают из воды, разлагая ее электрическим током (подвергая электролизу):
2H2O = 2H2+ O2 (электролиз).
В лаборатории
В лаборатории водород получают из соединений класса кислот: соляной, серной. Как же извлечь водород из кислот? Надо его в кислоте заместить металлом. (аппарат Киппа)
Лабораторный опыт
Алгоритм опыта:
*Подготовить пробирку
*Поместить в пробирку 2-3 кусочка цинка
*Прилить немного соляной кислоты
*Наблюдать выделение пузырьков водорода
*Собирать водород в пробирку (пробирка вверх дном)
*Проверить водород на чистоту.
Чистый водород вспыхивает со звуком, похожим на щелчок.
Составляем уравнение реакции.
Zn + 2HCl = ZnCl2 + H2↑
При получении водорода необходимо соблюдать технику безопасности и обязательно проверять его на чистоту. Вот какая история произошла с французским химиком, директором парижского музея науки Пилатом де Розье. Как-то он решил проверить, что будет, если вдохнуть водород. До него никто такого эксперимента не проводил. Не заметив никакого эффекта, учёный решил убедиться, проник ли водород в лёгкие? Он ещё раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в лёгких экспериментатора смешался с воздухом и произошёл сильный взрыв. “ Я думал, что у меня вылетели все зубы вместе с корнями”, – так Розье характеризовал испытанные ощущения. Эксперимент чуть не стоил ему жизни.
Проверка водорода на чистоту. Демонстрация аппарата Киппа. Водород можно получать и в аппарате Киппа, если его необходимо получить в большом количестве. Своё название аппарат Киппа получил по названию голландской фирмы производителя.
Взаимодействие активных металлов (IА и IIА гр кроме Be и Mg) с водой:
2Na + 2H2O = 2NaOH + H2↑
Учитель: Познакомимся с физическими свойствами водорода.
Все области применения водорода основаны в основном на физических свойствах водорода.
(Слайд 15) Простое вещество водород (Н2) – это газ, легче воздуха, без цвета, без запаха, без вкуса, tкип = – 2530С, водород в воде нерастворим, горюч. Собирать водород можно путем вытеснения воздуха из пробирки или воды. При этом пробирку нужно перевернуть вверх дном.
У водорода самая высокая теплопроводность среди всех газов и это свойство находит применение в современной энергетике для охлаждения электрических машин.
4. Этап закрепления новых знаний.
Контрольный тест.
Задание. Необходимо выбрать правильные утверждения. В путевых листах есть некие утверждения. Если вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус.
Вариант 1
Водород – самый распространённый элемент во Вселенной.
Водород – самый распространённый газ на Земле.
Основным соединением водорода на нашей планете является вода.
Большое количество атомов водорода входит в состав веществ, образующих живые организмы.
Валентность водорода равна 2.
Формула простого вещества водорода равна Н2.
Вариант 2
Газ водород обладает наименьшей среди всех веществ молекулярной массой.
Газообразный водород хорошо растворим в воде.
Водород в смеси с кислородом взрывоопасен.
Чтобы собрать водород, пробирку надо держать отверстием вверх.
Водород можно собрать методом вытеснения воды.
Водород образуется в результате разложения природного газа.
(Слайд 16) Учитель зачитывает ответы, учащиеся проверяют и оценивают: (Слайд 17) без единой ошибки – “5”, 1 ошибка – “4”, 2 ошибки – “3”, 3 и более ошибок – неудовлетворительно.
(Слайд 18) Задача. Зная свой вес и то, что в теле человека 10% атомов водорода вычислите массу атомов водорода в своём теле.
5. Осознание и осмысление учебной информации.
Задание
(Слайд 19) Сравним способы получения кислорода и водорода (беседа, заполнение таблицы)
Способы собирания
Водород
Кислород
Сходство
Методами вытеснения воды, воздуха
Методами вытеснения воды, воздуха
Различие
Отверстие сосуда вниз
Отверстие сосуда вверх
Способы распознавания
Водород
Кислород
Сходство
Тлеющая лучинка
Различие
Взрывоопасен
Поддерживает горение
Составьте «синквейн» для водорода по схеме:
*Название темы –одно существительное
*Описание темы – два прилагательных
*Описание действия – три глагола
*Отношение к теме – четыре слова
* Суть темы – одно слово
Водород!
Бесцветный, легкий.
В реакции вступает, восстанавливает, сгорает.
В смеси с кислородом взрывоопасен.
Рефлексия
1. Что нового узнали на уроке?
2. В чем испытывали затруднения?
3. Что понравилось и что не понравилось и почему?
4. Что теперь я могу?
5.Были ли моменты непонимания?
6.Мне это пригодится
Итоги
Выставление оценок за урок.
1. На уроке я работал активно/пассивно
2.Своей работой на уроке я доволен/ не доволен
3. Урок для меня показался коротким/ длинным
4. За урок я устал/ не устал
5. Мое настроение стало лучше/ стало хуже
6. Материал урока мне был понятен/ не понятен
интересен/ скучен
7 Домашнее задание мне кажется легким/ трудным
5. Этап информации учащимся о домашнем задании и инструкции по его выполнению
Подведение итогов урока. Оценивание. Домашнее задание.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Урок с использованием интерактивной доски (92 KB)
Урок с использованием интерактивной доски (92 KB)
 0
0 577
577 6
6 Нравится
0
Нравится
0







