
Строение атома Опыты Резерфорда

Актуализация знаний
- Что вам известно о строении вещества?
- Как мы узнаем о строении вещества?
- Каково строение атома?
- Как можно узнать
о строении атома?
- Имеет ли ядро атома
внутреннюю структуру?
- Что такое электрон?
- Входят ли электроны
в состав ядра?

Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад.
- Позиция Демокрита: «Существует предел деления – атом».
- Позиция Аристотеля:
« Делимость вещества бесконечна».

Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества.
1897 г - Дж. Дж. Томсон доказал существование электрона, измерил его заряд и массу.
1897 г - В. Вебер впервые высказал мысль об электронном строении атома ( электроны входят в состав атома).
1905 г - Ф. Линдеман утверждал, что атом кислорода имеет форму кольца, а атом серы- форму лепешки.
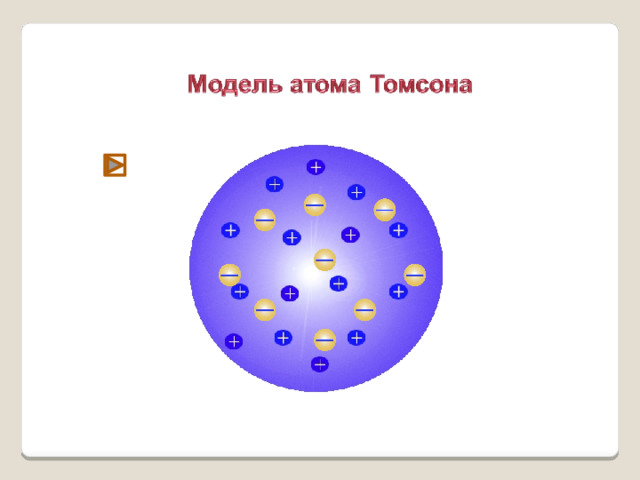
1903-1904 гг - Дж. Дж. Томсон предложил модель атома в виде положительно заряженного шара, в котором «плавают» электроны.

Модель строения атома Томсона
- Атом – шар, по всему объёму которого равномерно распределён положительный заряд.
- Внутри шара находятся электроны.
- Каждый электрон может совершать колебательные движения около своего положения равновесия.
- Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.

Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему объёму атома с постоянной плотностью.
В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов.

Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности.
Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома.
В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений. В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных частиц. Предсказал существование трансурановых элементов.
В 1908 г. ему была присуждена Нобелевская премия.

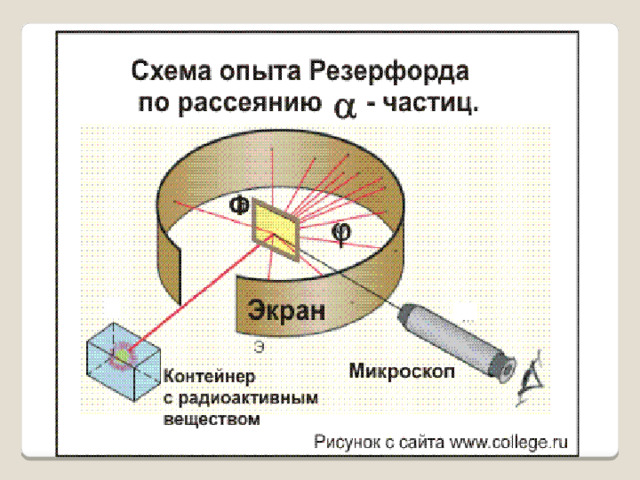
Идея опыта Резерфорда:
- Зондировать атом альфа–частицами.
- Альфа-частицы возникают при распаде радия.
- Масса альфа-частицы в 8000 раз больше массы электрона.
- Электрический заряд альфа-частицы в 2 раза больше заряда электрона.
- Скорость альфа-частицы около 15 000 км/с.
- Альфа-частица является ядром атома гелия.
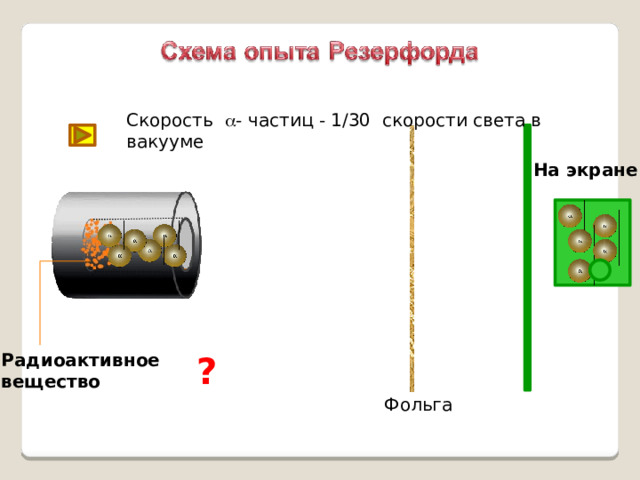
Скорость a - частиц - 1/30 скорости света в вакууме
На экране
Радиоактивное
?
вещество
Фольга
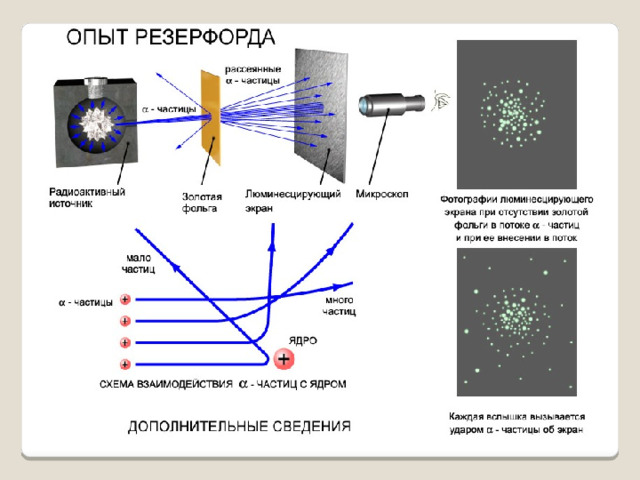

Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые углы; Некоторая небольшая часть альфа-частиц при прохождении через фольгу отклоняется на значительные углы ( 90,120,150 градусов);

Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º.
Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры, порядка 10 –14 м.
Электроны, по Резерфорду, движутся вокруг ядра.
Оказалось, что радиус ядра R (10 14 ÷ 10 15 )м и зависит от числа нуклонов в ядре.

Выводы из опытов:
- Положительный заряд сосредоточен в малой части атома – ядре;
- Практически вся масса атома сосредоточена в этом ядре;
- Отклонения альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов;
- Теоретические расчеты позволили оценить размеры ядер атомов – порядка 10-14 м, тогда как размеры атома в 10 000 раз больше.

На основе выводов из опытов Резерфордом была предложена планетарная модель атома
Конец ХIХ - начало ХХ века
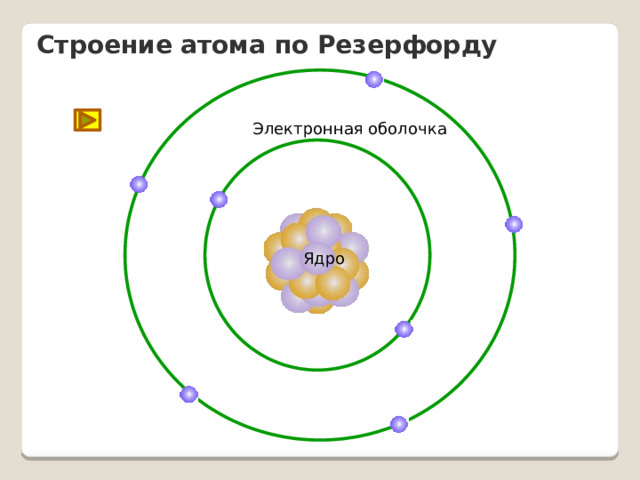
Строение атома по Резерфорду
Электронная оболочка
Ядро

Недостатки атома Резерфорда
- Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него.
- Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприменимы.

Попыткой спасения планетарной модели атома стали постулаты
Нильса Бора

Вопросы на закрепление:
- 1. В чём заключается сущность модели Томсона?
- 2. В чём заключалась идея опыта Резерфорда?
- 3. Объясните по схеме опыт Резерфорда по рассеиванию альфа-частиц.
- 4. Объясните причину рассеивания альфа-частиц атомами вещества.
- 5. В чём сущность планетарной модели атома?
- 6. В чем противоречивость модели атома Резерфорда?

 Получите свидетельство
Получите свидетельство Вход
Вход











 Строение атома. Опыты Резерфорда (1.14 MB)
Строение атома. Опыты Резерфорда (1.14 MB)
 0
0 800
800 6
6 Нравится
0
Нравится
0



