
Сера

Сера в природе
халькопирит CuFeS 2
галенит PbS
пирит FeS 2
киноварь HgS
самородная сера S
гипс Са SO 4 . 2H 2 O
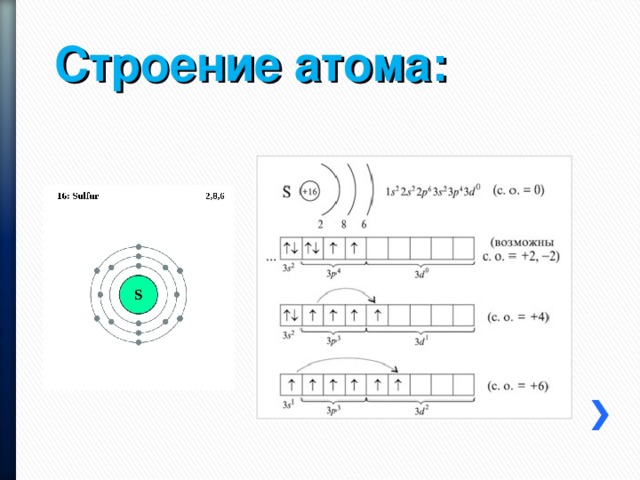
Строение атома:
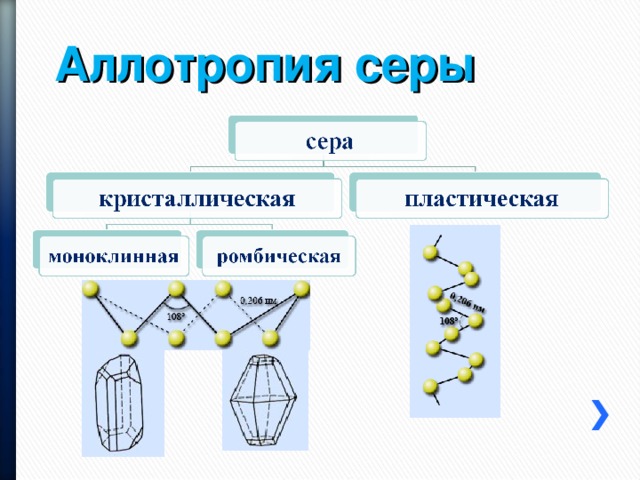
Аллотропия серы
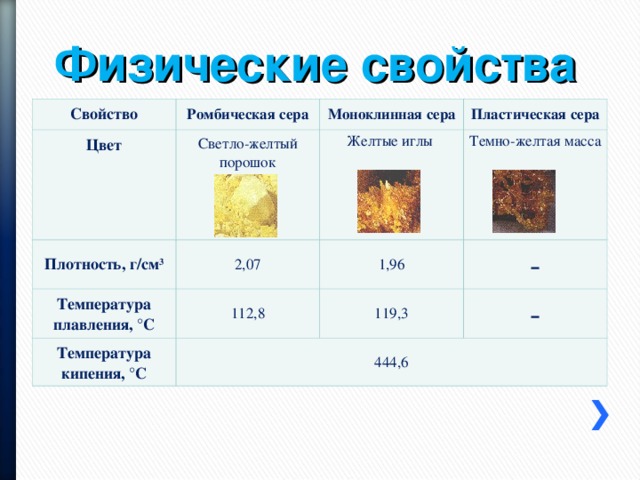
Физические свойства
Свойство
Ромбическая сера
Цвет
Моноклинная сера
Светло-желтый порошок
Плотность, г/см 3
Температура плавления, °С
Пластическая сера
Желтые иглы
2,07
Температура кипения, °С
112,8
1,96
Темно-желтая масса
-
119,3
444,6
-

Химические свойства
Сера – восстановитель
Сера – окислитель
При взаимодействии с какими веществами сера проявляет окислительные, а с какими – восстановительные свойства?
?

Химические свойства
Закончите уравнения реакций:
Сера – восстановитель
Сера – окислитель
S + O 2 =
S + F 2 =
S + H 2 =
S + Na =
S + Fe =
S + Hg =

Химические свойства
Закончите уравнения реакций:
Сера – окислитель
Сера – восстановитель
H 2 S
S + H 2 =
S + Na =
S + Fe =
S + Hg =
SO 2
S + O 2 =
S + F 2 =
Na 2 S
2
3
SF 6
FeS
HgS

Применение серы
- Производство серной кислоты
- Получение резины
- Получение гидросульфата кальция (для производства бумаги)
- Производство пороха, пиротехники
- Получение «сусального золота» – SnS 2
- В медицине для лечения кожных заболеваний
- В сельском хозяйстве для борьбы с вредителями

Биологическая роль серы
- Сера участвует в ОВР в организмах растений и животных
- Сера входит в состав белков и аминокислот
- Особенно много серы в волосах, шерсти, рогах, копытах
- Соединения серы обнаружены в хрящах, костях, в желчи
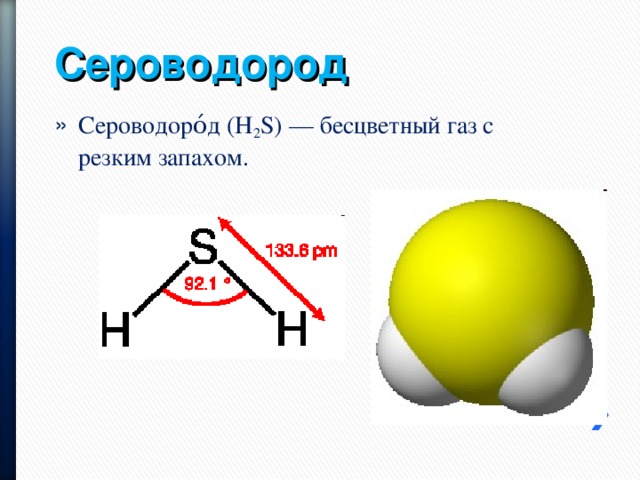
Сероводород
- Сероводоро́д (H 2 S) — бесцветный газ с резким запахом.

Нахождение в природе
- Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках.

Получение
- В лаборатории обычно получают действием разбавленных кислот на сульфиды:
FeS + 2HCl = FeCl 2 + H 2 S
- Или при добавлении к сульфиду алюминия воды:
Al 2 S 3 + H 2 O = 2Al(OH) 3 + H 2 S
(реакция отличается чистотой полученного сероводорода)

Физические свойства.
Сероводород - бесцветный газ с характерным запахом тухлых яиц, температура кипения -61 о С, плавления -88 о С.
При 20 о С в 1 объеме воды растворяется 3 объема сероводорода, образующийся раствор называют сероводородной водой.
Сероводород ядовит, вызывает тяжелые отравления, связывая железо, входящее в состав гемоглобина крови.

Химические свойства.
В водном растворе сероводород ведет себя как слабая двухосновная кислота:
H 2 S = H + + HS -
HS - = H + + S 2-
Сероводородная кислота дает два ряда солей - гидросульфиды и средние - сульфиды.

Применение
- В аналитической химии сероводород и сероводородная вода используются как реагент для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
- В медицине — в составе сероводородных ванн.
- Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
- В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья.

Тест.
1. Распределение электронов по энергетическим уровням в атоме серы:
а) 2, 6 б) 2, 8, 8 в) 2, 8, 6 г) 2, 8, 8, 6
2. Сера – более сильный окислитель, чем
а) Фтор б) Хлор в) Фосфор г) Кислород
3. Степени окисления серы изменяются с +6, -2, 0 в группе веществ
а) S, SO 2 , SO 3 б ) H 2 SO 4 , SO 2 , H 2 S
в) Na 2 SO 4 , K 2 S, S г ) SO 3 , K 2 SO 3 , S
4. Схема превращения S +6 S +4 соответствует уравнению реакции
а) SO 3 + H 2 O H 2 SO 4
б ) 2SO 2 + O 2 2SO 3
в) H 2 SO 4 + Zn ZnSO 4 + H 2
г ) Cu + 2H 2 SO 4 CuSO 4 + SO 2 + 2H 2 O

5. Для осуществления превращения H 2 S SO 2 SO 3 K 2 SO 4 нужно последовательно использовать
а) Воду, кислород, оксид калия
б) Кислород, кислород, гидроксид калия
в) Кислород, воду, калий
г) Воду, кислород, карбонат калия
6. Газ, обладающий запахом тухлых яиц, образующий при растворении в воде слабую кислоту, называется
а) Сернистый б) Угарный
в) Сероводород г) Йодоводород


 Получите свидетельство
Получите свидетельство Вход
Вход





























 Сера (презентация) (5.63 MB)
Сера (презентация) (5.63 MB)
 0
0 2271
2271 81
81 Нравится
0
Нравится
0



