
Количество вещества Молярная масса
Учитель химии, биологии и обществознания
Кривобок
Эллада Николаевна

Х имия – Наука о составе, строении, изменениях и превращениях, а также об образовании новых простых и сложных веществ.

В ещество — это любая совокупность атомов и молекул, находящаяся в определенном агрегатном состоянии

Mr (в-ва) = m (в-ва)
Mr (H 2 O) = 18 m (H 2 O) = 18
Mr (HCl) = 36,5 m (HCl) = 36,5
Mr (Ag) = 108 m (Ag) = 108
Mr (NaOH) = 40 m (NaOH) = 40
Mr (H 3 PO 4 ) = 98 m (H 3 PO 4 ) =98

Одинаковое число молекул (атомов) вещества содержится в массах численно равных их относительным молекулярным (атомным) массам
N A – постоянная Авогадро
Лоренцо Авогадро (1776 – 1856 гг.)
![Количество вещества n или [моль] Количество вещества - это физическая величина, которая определяется числом структурных единиц этого вещества ( молекул, атомов, ионов );](https://fsd.videouroki.net/html/2022/10/20/v_63512c318ef17/img5.jpg)
Количество вещества n или [моль]
Количество вещества - это физическая величина, которая определяется числом структурных единиц этого вещества ( молекул, атомов, ионов );

1 моль вещества всегда содержит одинаковое число молекул и равно 6,02 * 10 -23
N = N A n
N – число частиц (атомов, ионов, молекул)
![Масса 1 моль вещества называется молекулярной массой и обозначается M M (в-ва) = Mr (в-ва) [г/моль; кг/кмоль; мг/ммоль] ; n; М ( Н 2 ) = 2 г/моль М ( FeS ) = 88 г/моль М ( Fe ) = 56 г/моль М ( S ) = 32 г/моль](https://fsd.videouroki.net/html/2022/10/20/v_63512c318ef17/img7.jpg)
Масса 1 моль вещества называется молекулярной массой и обозначается M
M (в-ва) = Mr (в-ва)
[г/моль; кг/кмоль; мг/ммоль]
; n;
М ( Н 2 ) = 2 г/моль
М ( FeS ) = 88 г/моль
М ( Fe ) = 56 г/моль
М ( S ) = 32 г/моль
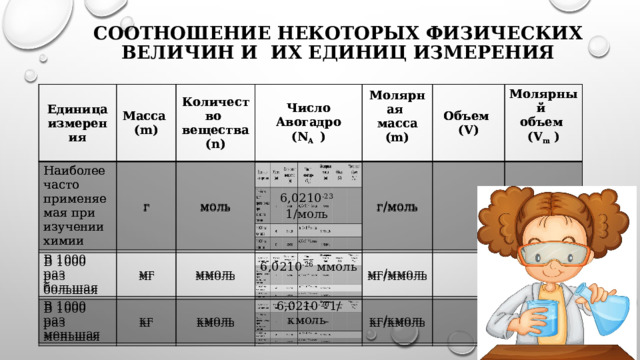
Соотношение некоторых физических величин и их единиц измерения
Единица
Единица
измерения
Масса
Масса
измерения
Наиболее часто применяемая при изучении химии
Наиболее часто применяемая при изучении химии
(m)
(m)
Количество
В 1000 раз
В 1000 раз
г
г
Количество
мг
большая
Число
вещества
вещества
Число
большая
мг
В 1000 раз
моль
В 1000 раз
моль
Авогадро
Авогадро
меньшая
кг
Молярная
меньшая
кг
ммоль
Молярная
6,0210 -23 1/моль
(n)
ммоль
(n)
Объем
(N A )
Объем
(N A )
масса
6,0210 -26 ммоль
масса
г/моль
кмоль
кмоль
г/моль
(V)
(V)
мг/ммоль
6,0210 -20 1/кмоль
мг/ммоль
Молярный
Молярный
(m)
(m)
объем
объем
кг/кмоль
кг/кмоль
(V m )
(V m )

Задача 1.
Сколько молекул содержит углекислый газ количеством вещества 2,5 моль?
Дано
Дано
N(CO 2 ) - ?
n(CO 2 ) = 2,5 моль
Решение
n(CO 2 ) = 2,5 моль
N = N A n
N A = 6,02 10 -23 1/моль
N(CO 2 ) = 6,02 10 -23 2,5 = 15,05 10 -23 (молекул)
Ответ: N(CO 2 ) = 15,05 10 -23 молекул
Ответ: N(CO 2 ) = 15,05 10 -23 молекул

Задача 2.
Какова масса железа (в граммах), соответствующая количеству вещества 0,25 моль?
Дано
Дано
m(Fe) - ?
n(Fe) = 0,25 моль
Решение
m(Fe) - ?
n(Fe) = 0,25 моль
M(Fe) = 56 г/моль
M(Fe) = 56 г/моль
n
m(Fe) = 56 0,25 = 14 (г)
Ответ: m(Fe) = 14г

Задача 3.
Определите массу атомов хлора, содержащегося в 29,25 г поваренной соли (NaCl)
Дано
Дано
m(Cl) - ?
m(Cl) - ?
Решение
; m = Mn
Ar(Cl) = 35,5
Ar(Cl) = 35,5
m(NaCl) = 29,25г
m(NaCl) = 29,25г
1. n(NaCl) = 29,25/58,5 = 0,5 (моль)
M(NaCl) = 23 + 35,5 =
M(NaCl) = 23 + 35,5 =
= 58,5(г/моль)
= 58,5(г/моль)
2. m(Cl) = 35,5 0,5 = 17,75(г)
Ответ: в 29,25 г хлорида натрия содержится 17,75г хлора
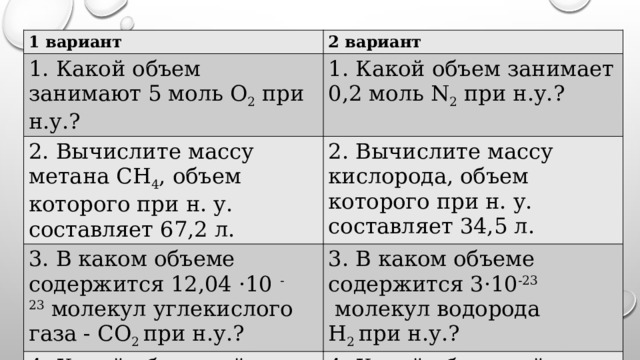
1 вариант
2 вариант
1. Какой объем занимают 5 моль О 2 при н.у.?
1. Какой объем занимает 0,2 моль N 2 при н.у.?
2. Вычислите массу метана СН 4 , объем которого при н. у. составляет 67,2 л.
2. Вычислите массу кислорода, объем которого при н. у. составляет 34,5 л.
3. В каком объеме содержится 12,04 ·10 -23 молекул углекислого газа - СО 2 при н.у.?
3. В каком объеме содержится 3·10 -23 молекул водорода Н 2 при н.у.?
4. Какой объем займут 8 г. газа О 2 при н.у.?
4. Какой объем займут 64 г. газа SО 2 при н.у.?

Домашнее задание
§ 16, презентацию изучить, знать таблицу из презентации,
упр.1а, 2б, 3в письменно

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация по химии "Количество вещества. Молярная масса" (1.36 MB)
Презентация по химии "Количество вещества. Молярная масса" (1.36 MB)
 0
0 1236
1236 136
136 Нравится
0
Нравится
0



