
Опыт Резерфорда. Постулаты Бора.

Отыщи всему начало, и ты многое поймешь. Козьма Прутков
- 400 г. до н.э. Демокрит: «Существует предел деления атома».
- Аристотель: «Делимость вещества бесконечна».
- 1626 г., Париж: учение об атоме запрещено под страхом смерти

- 1897. Джозеф Джон Томсон (1856 – 1940). Определил заряд и массу отдельного «атома» электричества.
- В природе существует материальный носитель наименьшего заряда – электрон. 1906 – 1914 г.г. Роберт Милликен (1868 – 1953). Провел эксперименты по точному определению массы и заряда электрона.
- m e = 9 , 109389 10 -31 кг ;
- q е = 1 ,602177 10 – 19 Кл

Модель атома Томсона
Явление радиоактивности давало основания предположить, что в состав атома входят отрицательно и положительно заряженные частицы.
Кроме того, было известно, что атом в целом нейтрален.

Модель атома Томсона
В 1903г. английский физик Джозеф Джон Томсон предложил одну из первых моделей строения атома – «кекс с изюмом»

Модель атома Томсона
По предположению Томсона, атом представлял собой шар радиусом ≈ 10 -10 м , по всему объему которого равномерно распределен положительный заряд.
Внутри этого шара находятся электроны, которые могут колебаться около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электрона, поэтому электрический заряд атома в целом равен нулю.

Опыт Резерфорда
Модель строения атома Томсона нуждалась в экспериментальной проверке.
Важно было проверить , действительно ли положительный заряд распределён по всему объёму атома с постоянной плотностью . Поэтому в 1906 г. Резерфорд совместно со своими сотрудниками провел ряд опытов по исследованию состава и строения атомов.

Идея опыта
- Зондировать атом альфа–частицами.
- Альфа-частицы возникают при распаде радия.
- Масса альфа-частицы в 8000 раз больше массы электрона.
- Электрический заряд альфа-частицы в 2 раза больше заряда электрона.
- Скорость альфа-частицы около 15 000 км/с.
- Альфа-частицы является ядром атома гелия.
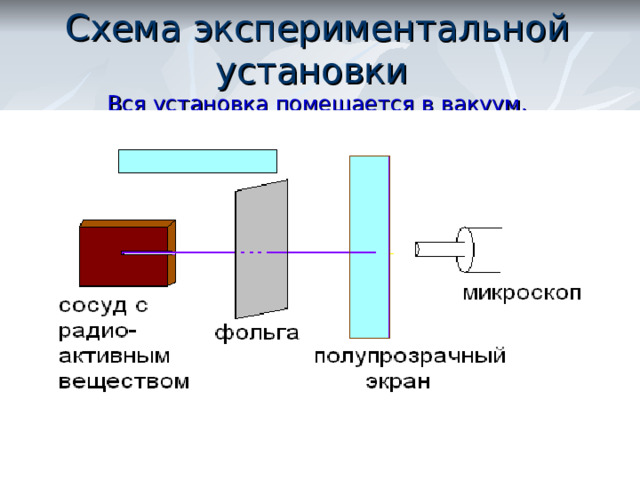
Схема экспериментальной установки Вся установка помещается в вакуум.

В отсутствии фольги – на экране появлялся светлый кружок напротив канала с радиоактивным веществом.

Когда на пути пучка альфа-частиц поместили фольгу, площадь пятна на экране увеличилась. Помещая экран сверху и снизу установки, Резерфорд обнаружил, что небольшое число альфа-частиц отклонилось на углы около 90 0 . Единичные частицы были отброшены назад.

Выводы из опыта Резерфорда
Именно случаи рассеяния α -частиц на большие углы привели Резерфорда к выводу:
Столь сильное отклонение α -частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле. Было рассчитано, что такое поле могло быть создано зарядом, сконцентрированным в очень малом объеме (по сравнению с объемом атома).

Выводы из опыта Резерфорда
Поскольку масса электрона примерно в 8 000 раз меньше массы α -частицы, электроны, входящие в состав атома, не могли существенным образом изменить направление движения α -частиц. Поэтому:
В данном случае речь может идти только о силах электрического отталкивания между α -частицами и положительно заряженной частью атома, масса которой значительно больше массы α -частицы.

Модель атома Резерфорда
- В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны.
- Основная масса атома сосредоточена в ядре m ядра = 99,4% m атома.
- В зависимости от массы ядро имеет диаметр порядка
10 -14 – 10 -15 м, т.е. оно в десятки или даже в сотни тысяч раз меньше атома (диаметр атома ≈ 10 -10 м).
- Атом электрически нейтрален: q ядра = + ∑ e .
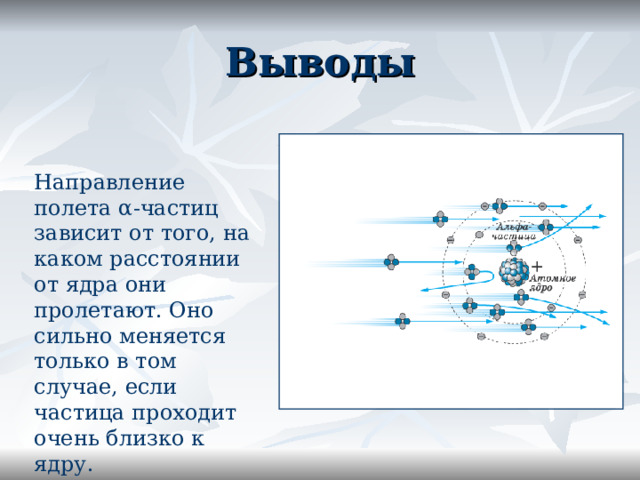
Выводы
Направление полета α -частиц зависит от того, на каком расстоянии от ядра они пролетают. Оно сильно меняется только в том случае, если частица проходит очень близко к ядру.

Выводы
Таким образом, в результате опытов по рассеянию α -частиц была доказана несостоятельность модели атома Томсона, выдвинута ядерная модель строения атома и определен порядок диаметров атомных ядер.
 излучение ЭМ волн с ν = ν обращения вокруг ядра = потеря Е = e по спирали к ядру = время существования e ≈ 10 -8 с. - электрон НО: АТОМ УСТОЙЧИВ! + " width="640"
излучение ЭМ волн с ν = ν обращения вокруг ядра = потеря Е = e по спирали к ядру = время существования e ≈ 10 -8 с. - электрон НО: АТОМ УСТОЙЧИВ! + " width="640"
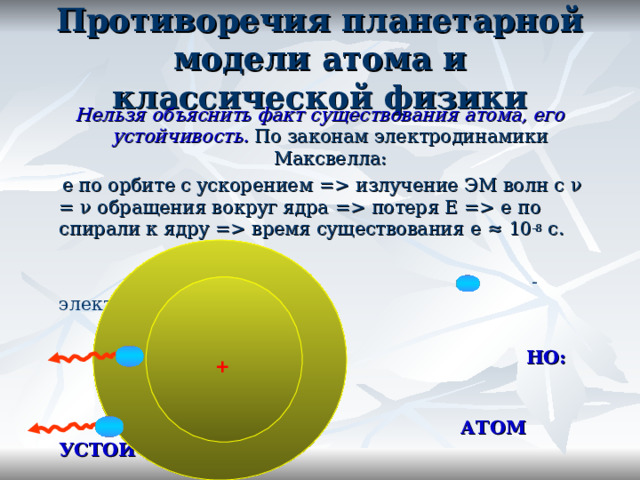
Противоречия планетарной модели атома и классической физики
Нельзя объяснить факт существования атома, его устойчивость. По законам электродинамики Максвелла:
e по орбите с ускорением = излучение ЭМ волн с ν = ν обращения вокруг ядра = потеря Е = e по спирали к ядру = время существования e ≈ 10 -8 с.
- электрон
НО:
АТОМ УСТОЙЧИВ!
+

Первый постулат Бора
Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия E n .
В стационарных состояниях атом не излучает.
-
+

Частота излучения
Второй постулат Бора
При переходе атома из стационарного состояния с большей энергией En в стационарное состояние с меньшей энергией Em излучается квант, энергия которого равна разности энергий стационарных состояний:
Е,эВ
Е 4
Е 3
h ν nm = E n – E m
Е 2
h – постоянная Планка
Излучает
Е 1
электрон
квант
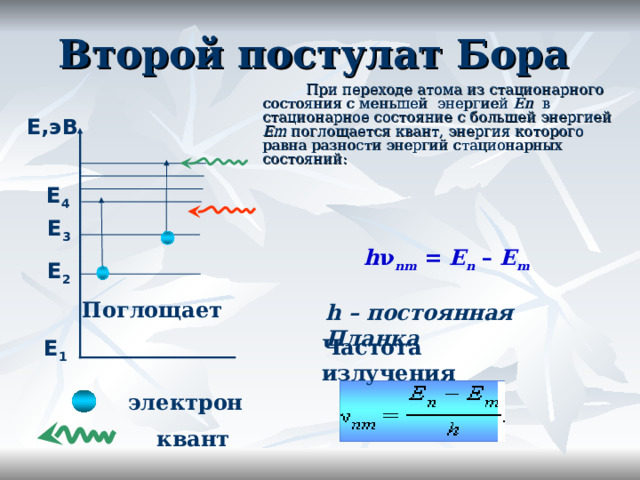
Второй постулат Бора
При переходе атома из стационарного состояния с меньшей энергией En в стационарное состояние с большей энергией Em поглощается квант, энергия которого равна разности энергий стационарных состояний:
Е,эВ
Е 4
Е 3
h ν nm = E n – E m
Е 2
Поглощает
h – постоянная Планка
Частота излучения
Е 1
электрон
квант
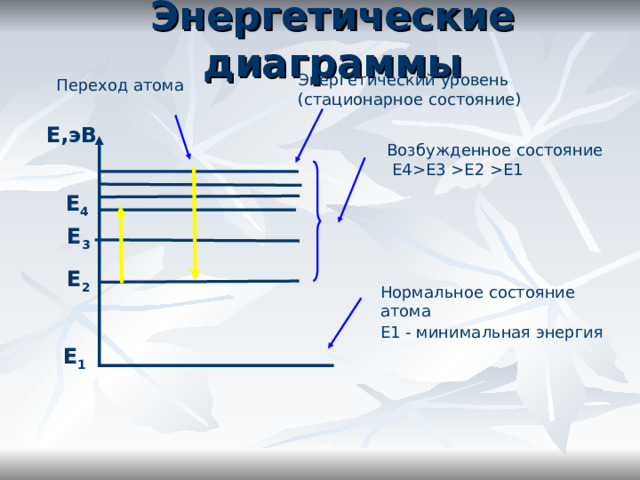 Е3 Е2 Е1 Е 4 Е 3 Е 2 Нормальное состояние атома Е1 - минимальная энергия Е 1 " width="640"
Е3 Е2 Е1 Е 4 Е 3 Е 2 Нормальное состояние атома Е1 - минимальная энергия Е 1 " width="640"
Энергетические диаграммы
Энергетический уровень (стационарное состояние)
Переход атома
Е,эВ
Возбужденное состояние
Е4 Е3 Е2 Е1
Е 4
Е 3
Е 2
Нормальное состояние атома
Е1 - минимальная энергия
Е 1

Правило квантования Бора
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса
m e - масса электрона,
υ – скорость электрона
r n – радиус стационарной круговой
орбиты
Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий
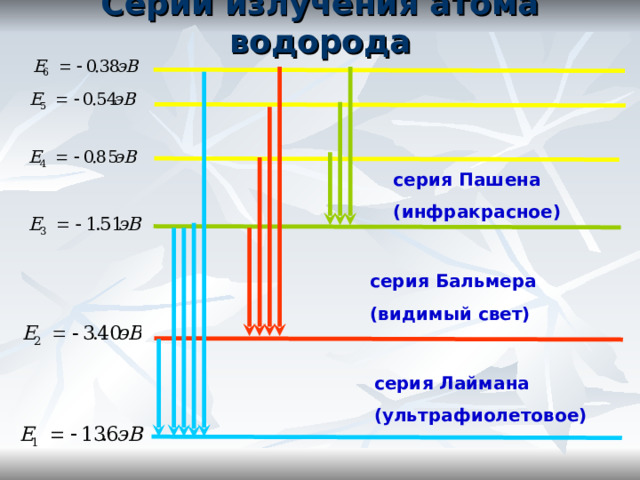
Серии излучения атома водорода
серия Пашена
(инфракрасное)
серия Бальмера
(видимый свет)
серия Лаймана
(ультрафиолетовое)

Достоинства теории Бора
- Позволила объяснить, почему атомы испускают линейчатые спектры и точно предсказать для атома водорода длины волн испускаемого излучения
- Позволила объяснить и спектры поглощения: столкновение фотона с атомом приводит к переходу электрона с одного энергетического уровня на другой, более высокий.
- Гарантировала стабильность атомов и позволила теоретически определить радиус атома водорода.
- Точно предсказала энергию ионизации водорода 13,6 эВ.

Недостатки теории Бора
- На основе теории не удалось количественно объяснить спектр более сложных атомов (гелия и др.).
- Правило квантования Бора применимо не всегда.
- Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось условным.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроку "Опыты Резерфорда. Квантовые постулаты Бора" (946.5 KB)
Презентация к уроку "Опыты Резерфорда. Квантовые постулаты Бора" (946.5 KB)
 0
0 606
606 73
73 Нравится
0
Нравится
0


