Атомы и молекулы. Молекулярное строение вещества.
Цели:
Образовательная: Объяснить строение вещества с точки зрения атомов и молекул. Объяснить строение кристаллической решётки с точки зрения различных веществ.
Развивающая: Развить умение учащихся применять данные знания на практике и в жизни.
Воспитательная: В целях развить научного мировоззрения учащихся показать роль физических экспериментов. Раскрыть причинно-следственные связи в изучаемом материале: атомы и молекулы, молекулярное строение вещества.
Оборудование:
Ход урока:
I.Проверка домашнего задания.
1.Упр2 №1.
| Дано:
|
|
|
![]() ,
, ![]()
Ответ: ![]()
2.Упр3 №1.
| Дано:
|
|
|
![]() ,
, ![]() ,
, ![]() ,
, ![]()
Ответ: ![]()
![]()
![]()
![]()
3.Упр4 №1.
8300=8,3∙103, 816200000=8,162∙108, 0,0527=527∙10-4, 0,000000029=2,9∙10-8
4.Какие причины вызывают погрешность измерений?
5.Какое значение имело введение Метрической системы мер?
II.Новый материал.
В окружающем нас мире встречается бесчисленное множество естественных, а также полученных искусственным путём веществ и тел.
?Из чего же состоит это множество тел и веществ, встречающихся в живой и неживой природе?
Учёные Древней Греции предполагали, что все вещества состоят из мельчайших частиц. Такие частицы Демокрит называл атомами.
Правильность предположения Демокрита о строении вещества на практике была доказана в XIX-XX вв.
Однако в начале XX века стало известно, что и атомы делимы, они состоят из ещё более мелких частиц.
Все вещества, встречающиеся в мире, имеют в своём составе атомы и молекулы всего лишь 92 элементов.
Благодаря различному соединению между собой атомов этих элементов обеспечено разнообразие всех веществ.
На основе соединения нескольких атомов образуется молекула.
Пример: H2O – 2 атома водорода, 1 атом кислорода. Все молекулы воды одинаковы, т.е. похожи друг на друга.
Молекулы разных веществ не похожи друг на друга, поэтому строение и свойства различных веществ разные.
С названиями элементов вы ознакомитесь в старших классах при изучении предмета химии.
Самый легкий из элементов H (водород), а самый тяжёлый уран. 99% веществ, встречающихся в космосе, состоят только из атомов водорода и гелия.
Нельзя объяснить многообразие веществ в природе только соединением атомов различных элементов в молекулы.
Можно получить вещества из атомов одного и того же элемента, отличающиеся по своим свойствам.
Пример: Очень мягкий графит и самое твёрдое в природе вещество – алмаз состоят только из атомов углерода.
Отличие их свойств связано с различным порядком расположения атомов углерода или расположения кристаллической решётки.
Стр31 рис21(графит) каждый атом углерода связан с тремя другими атомами углерода, рис22(алмаз) каждый атом углерода связан с четырьмя другими атомами углерода.
Молекула – это наименьшая частица данного вещества, характеризующая его свойства.
Порядок расположения атомов и молекул в кристалле можно наблюдать с помощью современных электронных микроскопов и ионных проекторов.
Электронные микроскопы увеличивают в сотни раз, а ионные проекторы в миллионы раз.
Чтобы представить размер молекулы, сравним: во сколько раз яблоко средней величины меньше земного шара, во столько же раз молекула меньше яблока.
Пример: В 1мм3 водорода при нормальных условиях содержится 2,7∙1016 молекул.
III.Закрепление нового материала.
1.Стр48 Упр5№1.
| Дано:
|
|
|
![]()
2.Сколько разновидностей атомов существует на Земле?
3.Одинаковы ли молекулы разных веществ?
Домашнее задание: §14, Стр48 Упр5№2.
3

 Получите свидетельство
Получите свидетельство Вход
Вход



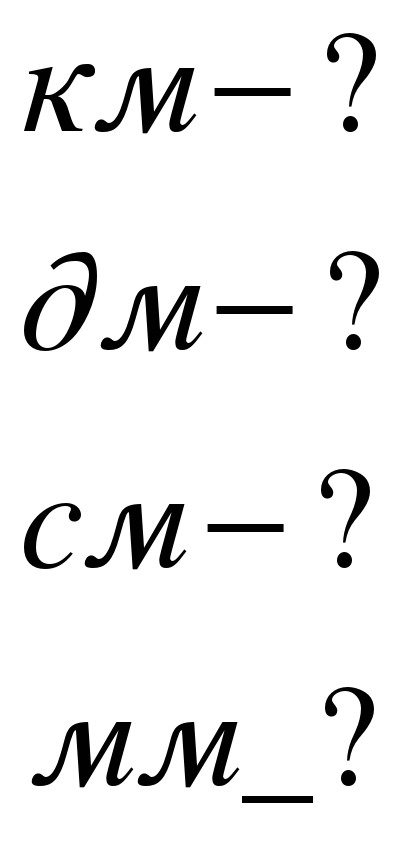









 План урока по физике 7 класс "Атомы и молекулы. Молекулярное строение вещества" (61.5 KB)
План урока по физике 7 класс "Атомы и молекулы. Молекулярное строение вещества" (61.5 KB)
 0
0 1158
1158 21
21 Нравится
0
Нравится
0


