ПЛАН ЗАНЯТИЯ 20
Тема: Агрегатные состояния вещества
Цели: а) образовательная: изучить физические особенности в строении и свойствах различных веществ, сформировать представление о свойствах твердых тел, жидкостей, газов.
б) воспитательная: воспитать логическое мышление, внимание, словесно-логическую память
в) развивающая: развитие умений учащихся наблюдать, сравнивать, применять ранее усвоенные знания в новой ситуации, анализировать, делать выводы.
Тип урока: Урок усвоения нового материала
Оборудование урока: интерактивная доска, презентация, видеоролик, вода, лед, пар.
Этапы урока
I) Организационный момент: Приветствие группы, проверка дежурства, состояние кабинета, наличие студентов, готовность к занятиям.
II) Проверка домашнего задания: карточки и устный опрос. Актуализация и мотивация познавательной деятельности студентов
III) Сообщение темы урока. Изложение нового материала. Объяснение с элементами беседы, показ видеороликов.
IV) Закрепление изученного материала: фронтальный опрос, зарисовка с комментарием фазовых переходов на доске
V) Подведение итогов урока: Ответы на вопросы
VI) Задание для самостоятельной работы студентов во внеурочное время:
Дмитриева Е.А. Глава 13. Заполнение таблицы.
Ход урока
I. Организационный момент: Приветствие группы, проверка дежурства, состояние кабинета, наличие студентов, готовность к занятиям.
II. Проверка домашнего задания: карточки и устный опрос.
12 человек получают карточки, остальные отвечают на вопросы задаваемые преподавателем.
Карточка с заданием для студентов
Критерии оценивания
| Баллы | Оценка |
| 7 | «5» отлично |
| 6-5 | «4» хорошо |
| 4-3 | «3» удовлетворительно |
| 2-0 | «2» неудовлетворительно |
Задание 1 (3 балла). Сформулируйте определения к следующим понятиям:
-
Манометр
-
Идеальный газ
-
Температура
Задание 2 (4 балла). Напишите формулы:
1) Кинетическая энергия
2) Потенциальная энергия
3) Полная механическая энергия
4) Давление
Устный опрос:
-
Назовите основные положения МКТ
-
Что такое атом?
-
Что такое молекула?
-
Что называют абсолютным нулем?
-
Дайте определение диффузии, приведите примеры. При какой температуре диффузия происходит быстрее.
III) Сообщение темы урока. Изложение нового материала. Объяснение с элементами беседы, показ видеороликов
На столе находится лед, холодная вода и кипяток.
– Посмотрите на стол, какие вещества вы видите? (лед, вода, пар).
– Какие это состояния вещества? (Твердое, жидкое, газообразное).
– Кто может сказать тему нашего урока? (Твердое, жидкое, газообразное состояние вещества).
Данные состояния называются агрегатными состояниями вещества. Любое вещество может находиться в трех агрегатных состояниях. Но свойства веществ в разных состояниях различны. Сегодня мы должны выяснить, какими свойствами обладают тела. Тема нашего урока «Агрегатные состояния вещества».
Какова цель нашего урока? ( Изучить свойства агрегатных состояний и их строение).
– Где мы сможем использовать знания по этой теме? (Многие производства основаны на знаниях о поведении и свойствах веществ, находящихся в разных агрегатных состояниях, для получения сплавов, работа паровых турбин, различные природные явления, круговорот воды, и т.д).
– Каковы особенности молекулярного строения газов, жидкостей и твердых тел? Давайте зарисуем строение жидких, твердых и газообразных тел.
В газах расстояния между молекулами значительно большие, чем размеры молекул. Молекулы хаотически движутся, относительно редко соприкасаются друг с другом. Они слабо взаимодействуют друг с другом. Когда мы сжимаем газ, молекулы не изменяются: уменьшаются только расстояния между ними.
Молекулы жидкости расположены достаточно плотно, между ними есть небольшие промежутки. Если представить, что молекулы – это шарики, то эти шарики касаются друг друга. Молекулы и здесь находятся в непрерывном движении, но характер движения уже другой: почти всё время молекулы колеблются (будто дрожат), и только иногда проскакивают между ближайшими соседками и немного меняют своё место. Определённого порядка в расположении молекул нет. Это очень напоминает расположение и движение людей в толпе во время каких-нибудь митингов, демонстраций.
Что касается твёрдого тела, то расположение молекул больше напоминает парадную военную шеренгу (такое расположение называют кристаллической решёткой). Движение молекул сводится к колебаниям вблизи «своего места в шеренге».
Существуют и такие тела, которые по большинству признаков мы относим к твёрдым, но по расположению молекул они больше напоминают жидкость (в этих телах отсутствует кристаллическая решётка). Такие тела называют аморфными. Это стекло, смола, пластмасса и т.д. Если их нагревать, то нельзя определить температуру плавления: их превращение в обычную жидкость происходит постепенно, они как будто становятся мягче.
– Каждое агрегатное состояние вещества обладает своими свойствами. Рассмотрим же эти свойства.
Свойства газов:
-
Объём и форму не сохраняют.
-
Расстояние между молекулами большое, во много раз больше самих молекул.
-
Легко сжимаемы.
-
Молекулы газов совершают беспорядочное движение, поэтому заполняют собой весь предоставленный им объём.
-
При повышении температуры расширяются. Если сосуд отсутствует, то расширяются неограниченно.
Свойства твердых тел:
-
Объём и форму сохраняют
-
Молекулы соединены кристаллической решеткой
-
Сильное взаимодействие между молекулами
-
Сжатие почти невозможно
Аморфные тела:
-
Не имеют кристаллическую решетку
-
Не имеют температуры плавления
-
Обладают текучестью
-
Изотропны
Свойства жидких тел:
-
Объем сохраняют
-
Форму не сохраняют
-
Сжатие почти не возможно
-
Значительные взаимодействия между молекулами
-
Не могут далеко удаляться друг от друга.
– Что такое испарение?
Испарение – процесс фазового перехода вещества из жидкого состояния в парообразное или газообразное, происходящий на поверхности вещества. Важным фактором испарения является площадь поверхности жидкости, с которой происходит испарение: из узкого стакана оно будет происходить медленнее, чем из широкой тарелки.
– Какое явление называют сублимацией? Испарение твердого тела называется сублимацией (возгонкой). Вывешенное на мороз влажное белье через несколько минут замерзает и становится жестким как лист картона или фанеры. Однако через двое-трое суток оно уже совершенно свободно от льда – мягкое, эластичное и практически сухое. Лед перешел из твердой кристаллической фазы непосредственно в пар, минуя плавление. Такое «сухое» испарение называется сублимацией, или возгонкой. Сублимация льда возможна практически при любой отрицательной температуре, но при одном условии: влажность воздуха должна быть достаточно низкой. Сублимация происходит с поглощением теплоты, причем для некоторых веществ теплота сублимации весьма велика.
Сублимация в кометах. При приближении кометы Галлея к Солнцу с поверхности её ядра начинают сублимироваться летучие вещества с малой температурой кипения, такие как вода, моноксид, оксид углерода, метан, азот и, возможно, другие замёрзшие газы. Этот процесс приводит к образованию хвоста кометы, которая может в поперечнике достигать 100 000 км. Испарение этого грязного льда высвобождает пылевые частицы, которые относятся газом от ядра. Молекулы газов в коме поглощают солнечный свет и переизлучают его затем на разных длинах волн (это явление называется флуоресценцией), а пылевые частицы рассеивают солнечный свет в различных направлениях без изменения длины волны. Оба эти процесса приводят к тому, что кома становится видимой для стороннего наблюдателя.
– Какое явление называют конденсацией? Конденсация паров – переход вещества в жидкое или твёрдое состояние из газообразного. Максимальная температура, ниже которой происходит конденсация, называется критической. Пар, из которого может происходить конденсация, бывает насыщенным или ненасыщенным.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Жидкость в закрытом сосуде вначале будет испаряться и плотность пара над ней будет увеличиваться. Однако чем больше молекул покидает жидкость, тем больше возвращаются. Чем больше плотность пара, тем больше молекул возвращаются в жидкость. При постоянной температуре в закрытом сосуде в результате установится динамическое равновесие т.е в среднем, количество молекул, покинувших жидкость, равно количеству молекул, вернувшихся в жидкость.
Если изменить объём насыщенного пара, то равновесие нарушится, но со временем плотность пара, а следовательно и концентрация молекул, вернутся в прежнее значение – это значит, что плотность пара и концентрация молекул в насыщенном паре не зависят от его объёма.
– Какое явление называют кипением? Кипение — процесс интенсивного парообразования, который происходит как со свободной поверхности жидкости, так и внутри неё. При этом в объёме жидкости возникают границы разделения фаз, то есть на стенках сосуда образуются пузырьки, которые содержат воздух и насыщенный пар. Кипение, как и испарение, является одним из способов парообразования. В отличии от испарения, кипение может происходить лишь при определённой температуре и давлении. Температура, при которой происходит кипение жидкости, находящейся под постоянным давлением, называется температурой кипения.
Температура кипения жидкостей зависит от внешнего давления , чем оно больше, тем больше температура кипения.
Критическая температура – это температура, при которой исчезают различия в физических свойствах между жидкостью и её насыщенным паром.
Пар имеющий температуру ниже критической – ненасыщенный пар.
Плавление вещества − переход вещества из твердого состояния в жидкое. Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. Плавление происходит только при определенной температуре, называемой температурой плавления. Каждое вещество имеет свою температуру плавления. Пока происходит плавление, температура вещества не изменяется.
Кристаллизация (затвердевание) вещества − переход вещества из жидкого состояния в твердое. Это процесс, обратный плавлению. Кристаллизация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. Она происходит только при определенной температуре, совпадающей с температурой плавления. Пока происходит кристаллизация, температура вещества не изменяется.
Интересный парадокс! Что быстрее замерзнет кипяток или вода при комнатной температуре?
IV) Закрепление изученного материала: фронтальный опрос, зарисовка с комментарием фазовых переходов на доске
На доске рисуем схему – фазовые переходы вещества.
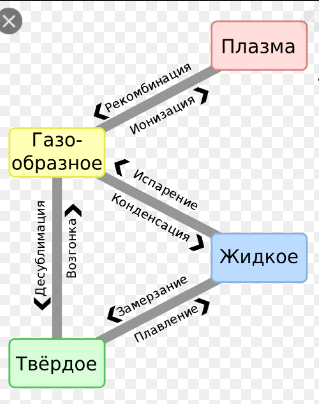
V) Подведение итогов урока:
Какую тему изучили сегодня на уроке?
– Чем запомнился урок?
– Что нового узнали на уроке?
– Какое практическое значение имеют явления перехода вещества из одного агрегатного состояния в другое?
VI) Задание для самостоятельной работы студентов во внеурочное время:
Дмитриева Е.А. Глава 13. Заполнение таблицы:
|
| Газообразные тела | Жидкие тела | Твердые тела |
| Форма |
|
|
|
| Объем |
|
|
|
| Расположение молекул |
|
|
|
| Взаимодействие между молекулами |
|
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход












 План-конспект урока на тему: "Агрегатные состояния вещества" (64.36 KB)
План-конспект урока на тему: "Агрегатные состояния вещества" (64.36 KB)
 0
0 812
812 63
63 Нравится
0
Нравится
0


