
40 (С5) Нахождение молекулярной формулы веществ
Решение задачи будет включать четыре последовательные операции :
- нахождение количества вещества по химической реакции (продуктам горения);
- определение молекулярной формулы вещества;
- составление структурной формулы вещества, исходя из молекулярной формулы и качественной реакции;
- составление уравнения качественной реакции.

Формула
Химическая формула — условное обозначение химического состава и структуры веществ с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т.п.).
- Истинная (брутто-формула, молекулярная )– отражает состав (точное количество атомов каждого элемента в одной молекуле), но не структуру молекул вещества.
- Простейшая формула – формула, в которой отражено минимальное целочисленное отношение химических элементов.
Истинная формула может совпадать с простейшей или быть кратной ей. Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная плотность газа или другие данные, с помощью которых можно определить молярную массу вещества.
- Структурная формула – это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости.

Относительная плотность газа по газу
- Относительная плотность — это величина, которая показывает, во сколько раз газ тяжелее газа . Её рассчитывают как отношение молярных масс газов и :
Часто для расчетов используют относительные плотности газов по водороду и по воздуху .
- Относительная плотность газа по водороду:
- Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава). Поэтому:

Решим задачу:
При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды. Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди (II) образуется кетон.
На основании данных условия задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди (II).

При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды. Известно, что относительная плотность паров этого вещества по водороду равна 37.
40
Решение:
С x H y + O 2 CO 2 + H 2 O
Дано:
1) а) С → CO 2
n ( CO 2 ) = m / M = 35,2 г / 44 г/моль = 0 ,80 моль
n ( CO 2 ) = n ( C ) = 0,8 моль
б) 2Н → H 2 O
n ( H 2 O ) = 18,0 г / 18 г/моль = 1 ,0 моль
n (Н) = 2 n ( H 2 O ) = 2,0 моль
m ( С х H y O z ) = 14 , 8 г
0, 80 моль 0, 8 0 моль
m (CO 2 ) = 35,2 г
m (H 2 O) = 18 г
D H 2 = 37
С х H y O z – ?
2 , 0 моль 1 ,0 моль
M (CO 2 ) = 44 г/моль
M (H 2 O ) = 18 г/моль

m (в-ва)= m ( C) + m ( H) + m (О ) m = n · M
в) m ( C) + m ( H) = 0,8·12 + 2,0·1 = 11,6 г (кислород имеется)
m (О ) = 14,8 г – 11,6 г = 3,2 г
n ( O ) = 3,2 / 16 = 0, 20 моль
2) Определяем истинную формулу вещества:
M ист (С х H у O z ) = D H 2 · M H 2 = 37 · 2 = 74 г/моль
х : y : z = 0,80 : 2,0 : 0,20 = 4 : 10 : 1
Вычисленная простейшая формула – С 4 H 10 O
M выч (С 4 H 10 O ) = 74 г/моль
Истинная формула (молекулярная) исходного вещества – С 4 H 10 O

40
3) Составляем структурную формулу вещества исходя из истинной формулы и качественной реакции:
4) Записываем уравнение реакции вещества с оксидом меди (II) :

Задача 2.
При сгорании вторичного амина получили 26,88 л (н.у.) углекислого газа, 32,4г воды и 4,48 л (н.у.) азота.
На основании данных условия задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с хлорэтаном.

При сгорании вторичного амина получили 26,88 л (н.у.) углекислого газа, 32,4 г воды и 4,48 л (н.у.) азота.
40
Решение:
R 2 NH + O 2 CO 2 + H 2 O + N 2
Дано:
V (CO 2 ) = 26,88 л
1) а) С → CO 2
n ( CO 2 ) = V / V m = 26 , 88 л / 22,4 л/моль = 1,2 моль
n ( CO 2 ) = n ( C ) = 1,2 моль
б) 2Н → H 2 O
n ( H 2 O ) = m / M = 32,4 г / 18 г/моль = 1 , 8 моль
n (Н) = 2 n ( H 2 O ) = 3 , 6 моль
1,2 моль 1,2 моль
V (H 2 O) = 32,4 г
V (N 2 ) = 4,48 л
R 2 NH – ?
V m = 22,4 л/моль
M (H 2 O ) = 18 г/моль
3,6 моль 1 ,8 моль

40
в) 2N → N 2
n ( N 2 ) = V m / V = 4,4 8 л / 22,4 л/моль = 0 ,2 0 моль
n ( N ) = n (( N 2 ) = 0 , 40 моль
2) Определяем простейшую формулу вещества:
n ( C ) : n ( H ) : n ( N ) = 1,2 : 3,6 : 0,40 = 3 : 9 : 1
Вычисленная простейшая формула – С 3 H 9 N
Истинная формула исходного вещества – СH 3 – NH – C 2 H 5
0 , 40 моль 0 ,2 0 моль
40
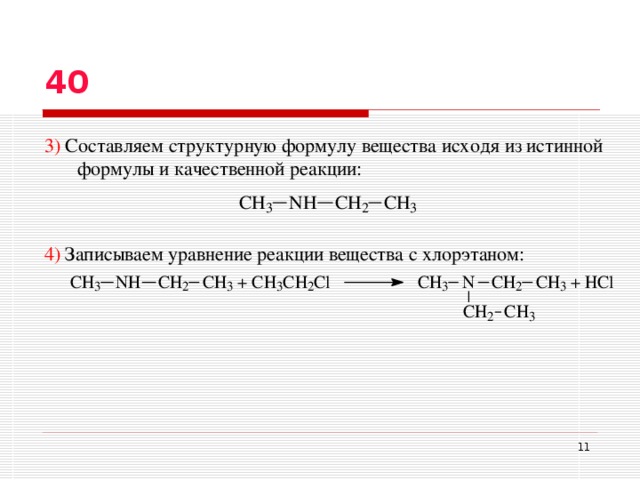
3) Составляем структурную формулу вещества исходя из истинной формулы и качественной реакции:
4) Записываем уравнение реакции вещества с хлорэтаном:

Спасибо за внимание!


 Получите свидетельство
Получите свидетельство Вход
Вход
























 Мастер класс по решению задач ЕГЭ (презентация) (0.25 MB)
Мастер класс по решению задач ЕГЭ (презентация) (0.25 MB)
 0
0 2792
2792 220
220 Нравится
0
Нравится
0


