
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ

ЦЕЛИ УРОКА:
Цели урока:
- Формирование знаний о комплексных соединениях;
- Рассмотрение химических свойства комплексных соединений;
- Углубление знаний о номенклатуре и способах получения комплексных соединений;
- Проверить степень усвоения знаний учащихся о комплексных соединениях;
- Ознакомить учащихся с применением комплексных соединений;
- Продолжить формирование мировоззренческих понятий: о познаваемости природы, причинно – следственной зависимости между составом и свойствами соединений.

Содержание урока
1. Понятие :
- Комплексные соединения
2. Строение комплексных соединений
3. Номенклатура комплексных соединений
4. Химические свойства
5. Применение
6. Закрепление

Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию, как в кристаллическом виде, так и в растворах.

Альфред ВЕРНЕР (Werner A.) (12.XII.1866 - 15.XI.1919)
Швейцарский химик Альфред Вернер, лауреат Нобелевской премии.
Его научная деятельность проходила в Цюрихском университете.
Ученый синтезировал много новых комплексных соединений,
систематизировал ранее известные и вновь полученные
комплексные соединения и разработал экспериментальные методы
доказательства его строения
Альфред ВЕРНЕР (Werner A.) (12.XII.1866 - 15.XI.1919)

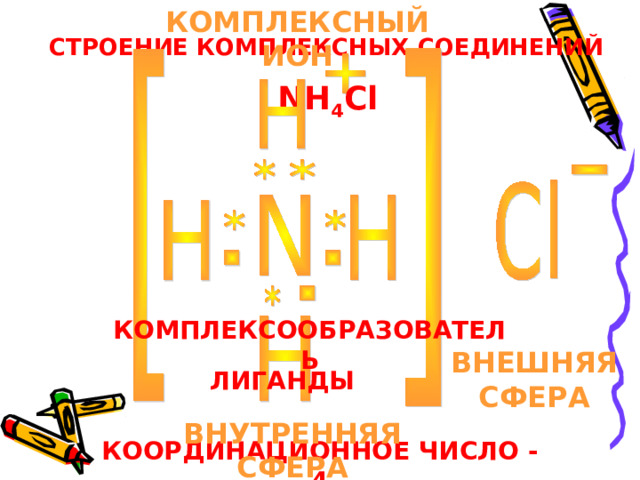
КОМПЛЕКСНЫЙ ИОН
СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
NH 4 Cl
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ВНЕШНЯЯ СФЕРА
ЛИГАНДЫ
ВНУТРЕННЯЯ СФЕРА
КООРДИНАЦИОННОЕ ЧИСЛО - 4
![[N -3 H +1 4 ]Cl -1 ВНУТРЕННЯЯ СФЕРА : [NH 4 ] + КОМПЛЕКСНЫЙ ИОН N -3 КОМПЛЕКСООБРАЗОВАТЕЛЬ H + ЛИГАНДЫ Cl - ВНЕШНЯЯ СФЕРА АНИОН](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img7.jpg)
[N -3 H +1 4 ]Cl -1
ВНУТРЕННЯЯ СФЕРА :
[NH 4 ] +
КОМПЛЕКСНЫЙ ИОН
N -3
КОМПЛЕКСООБРАЗОВАТЕЛЬ
H +
ЛИГАНДЫ
Cl -
ВНЕШНЯЯ СФЕРА
АНИОН
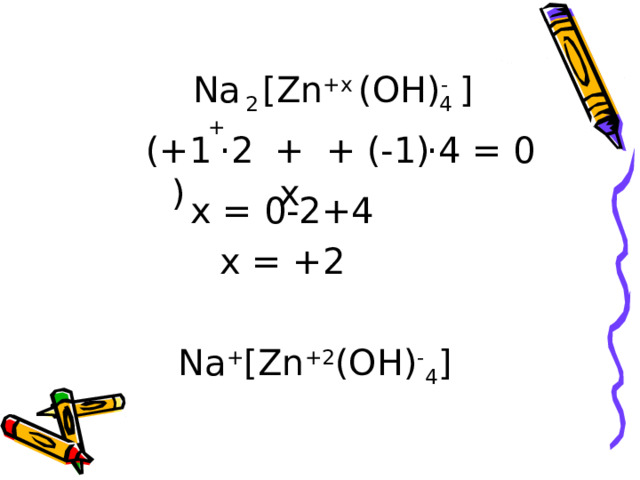
Лигандами могут быть: а) полярные молекулы: NH 3 H 2 O CO NO б) простые ионы CI - Br - I - в) сложные ионы CN - SCN - NO 2- OH -
![(OH) - 4 [Zn +x Na + ] 2 (+1) + x + (-1) ·2 ·4 = 0 x = 0-2+4 x = +2 Na + [Zn +2 (OH) - 4 ]](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img9.jpg)
(OH) -
4
[Zn +x
Na +
]
2
(+1)
+ x
+ (-1)
·2
·4 = 0
x = 0-2+4
x = +2
Na + [Zn +2 (OH) - 4 ]
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na 3 [AlF 6 ] Ответ: Na + 3 [Al +3 F - 6 ] K[MgCl 3 ] Ответ: K + [Mg +2 Cl - 3 ] Na[Al(OH) 4 ] Ответ: Na + [Al +3 (OH) - 4 ] Na 4 [Fe(CN) 6 ] Ответ: Na + 4 [Fe +2 (CN) - 6 ]](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img10.jpg)
РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na 3 [AlF 6 ]
Ответ: Na + 3 [Al +3 F - 6 ]
K[MgCl 3 ]
Ответ: K + [Mg +2 Cl - 3 ]
Na[Al(OH) 4 ]
Ответ: Na + [Al +3 (OH) - 4 ]
Na 4 [Fe(CN) 6 ]
Ответ: Na + 4 [Fe +2 (CN) - 6 ]

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
ди -
2-
H 2 O - аква
3-
три -
NH 3 - амин
4-
тетра -
С O - карбонил
5-
пента -
O Н - - гидроксо-
гекса -
6-
(С N) - - циано
( NO 3 ) - - нитро
F - , Cl - , Br - , I - - фторо-, хлоро-, бромо-, йодо-

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ КАТИОНОВ :
Fe - феррат
Cu - купрат
Ag - аргентат
Au - аурат
Al - алюминат
Zn - цинкат
Hg - меркурат
![НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na + 2 4 ] (OH) - [Zn +2 тетра цинкат натрия гидроксо 6 ] Cl - 3 (H 2 O) 0 [Cr +3 хлорид аква гекса x рома (III) K + 2 [Hg +2 4 ] I - тетра йодо меркурат (II) калия](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img13.jpg)
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na + 2
4 ]
(OH) -
[Zn +2
тетра
цинкат
натрия
гидроксо
6 ]
Cl - 3
(H 2 O) 0
[Cr +3
хлорид
аква
гекса
x рома (III)
K + 2
[Hg +2
4 ]
I -
тетра
йодо
меркурат (II)
калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na 3 [AlF 6 ] Гексафтороалюминат натрия Na[Al(OH) 4 ] Тетрагидроксоалюминат натрия K 4 [Fe(CN) 6 ] Гексационоферрат (II) калия](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img14.jpg)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na 3 [AlF 6 ]
Гексафтороалюминат натрия
Na[Al(OH) 4 ]
Тетрагидроксоалюминат натрия
K 4 [Fe(CN) 6 ]
Гексационоферрат (II) калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH 3 ) 4 ]SO 4 Сульфат тетраамминмеди (II) [Ag(NH 3 ) 2 ]Cl Хлорид диамминсеребра [Cr(H 2 O) 6 ]Cl 3 Хлорид гексааквахрома (III)](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img15.jpg)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH 3 ) 4 ]SO 4
Сульфат тетраамминмеди (II)
[Ag(NH 3 ) 2 ]Cl
Хлорид диамминсеребра
[Cr(H 2 O) 6 ]Cl 3
Хлорид гексааквахрома (III)
![СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Гексахлороплатинат (IV) калия Ответ: K 2 [PtCl 6 ] Гексагидроксохромат (III) натрия Ответ: Na 3 [Cr(OH) 6 ]](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img16.jpg)
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Гексахлороплатинат (IV) калия
Ответ: K 2 [PtCl 6 ]
Гексагидроксохромат (III) натрия
Ответ: Na 3 [Cr(OH) 6 ]
 2 . = [Cu(NH 3 ) 4 ] 2 + +2ОН - . [Cu(NH 3 ) 4 ] 2+ ↔ Cu 2 + + 4NH 3](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img17.jpg)
1. Диссоциация комплексных соединений.
ХИМИЧЕСКИЕ СВОЙСТВА
[Cu(NH 3 ) 4 ](OH) 2 . = [Cu(NH 3 ) 4 ] 2 + +2ОН - .
[Cu(NH 3 ) 4 ] 2+ ↔ Cu 2 + + 4NH 3
![Химические свойства 2. Комплексные соединения взаимодействуют с оксидом углерода ( I V): Na[AL(OH) 4 ] + CO 2 = AL(OH) 3 + NaHCO 3](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img18.jpg)
Химические свойства
2. Комплексные соединения взаимодействуют с оксидом углерода ( I V):
Na[AL(OH) 4 ] + CO 2 = AL(OH) 3 + NaHCO 3
![Химические свойства 3. Комплексные соединения взаимодействуют с кислотами: [Cu(NH 3 ) 4 ]SO 4 + BaCl 2 = BaSO 4 + [Cu(NH 3 ) 4 ]Cl 2 FeCl 3 + K 4 [Fe(CN) 6 ] = Fe 4 [Fe(CN) 6 ] 3 + 3KCl Na[AL(OH) 4 ] + HCL = NaCL + AL(OH) 3 + H 2 O Na[AL(OH) 4 ] + 4HCL = NaCL + 4H 2 O + ALCL 3](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img19.jpg)
Химические свойства
3. Комплексные соединения взаимодействуют с кислотами:
[Cu(NH 3 ) 4 ]SO 4 + BaCl 2 = BaSO 4 + [Cu(NH 3 ) 4 ]Cl 2
FeCl 3 + K 4 [Fe(CN) 6 ] = Fe 4 [Fe(CN) 6 ] 3 + 3KCl
Na[AL(OH) 4 ] + HCL = NaCL + AL(OH) 3 + H 2 O
Na[AL(OH) 4 ] + 4HCL = NaCL + 4H 2 O + ALCL 3
![Химические свойства 4. Комплексные соединения взаимодействуют с солями – реакции обмена: Na[AL(OH) 4 ] + ALCL 3 = 4AL(OH) 3 + 3NaCL [Ag(NH 3 ) 2 ]CL + KJ = AgJ↓+ NH 3 + KCL](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img20.jpg)
Химические свойства
4. Комплексные соединения взаимодействуют с солями – реакции обмена:
- Na[AL(OH) 4 ] + ALCL 3 = 4AL(OH) 3 + 3NaCL
- [Ag(NH 3 ) 2 ]CL + KJ = AgJ↓+ NH 3 + KCL
![Химические свойства 5 .Комплексные соединения вступают в окислительно-восстановительные реакции: K 3 [Fe 3 +(CN) 6 ] 3 + H 2 O 2 + 2KOH = 2K 4 [Fe 2+ (CN) 6 ] 4 + O 2 + 2H 2 O](https://fsd.videouroki.net/html/2023/04/21/v_644277b40f688/img21.jpg)
Химические свойства
5 .Комплексные соединения вступают в окислительно-восстановительные реакции:
- K 3 [Fe 3 +(CN) 6 ] 3 + H 2 O 2 + 2KOH =
2K 4 [Fe 2+ (CN) 6 ] 4 + O 2 + 2H 2 O

Практическое применение комплексных соединений
- 1) в аналитической химии для определения многих ионов
- 2) для разделения некоторых металлов
- 3) для получения металлов высокой степени чистоты (золота, серебра, никеля и др.)
- 4) в качестве красителей
- 5) для устранения жесткости

Закрепление
Задание 2
Заполните пропуски в листе рассказа «Комплексные соединения».
- Строение комплексных соединений объясняется с позиций … теории швейцарского ученого Альфреда Вернера.
- Согласно названной теории в комплексном соединении различают две сферы – …
- В комплексных соединениях центральный ион или атом металла, называется …, он удерживает вокруг себя некоторое число ионов или молекул, называемых … (от лат. ligo – «связываю»).
- Совокупность … и … называется … сферой комплекса (комплексным ионом).
- Комплексообразователь связан с лигандами … связями, образованными по … механизму.

Домашнее задание
Напишите формулы следующих соединений:
- 1) сульфат гексаамминхрома ( II );
- 2) нитрат гидроксодиамминакваплатины ( II );
- 3) гексацианоферрат ( II ) калия;
- 4) тетрагидроксокупрат ( II ) натрия;
- 5) трихлоротриамминкобальт ( III ).
- Определите: а) заряд внутренней сферы, б) степень окисления комплексообразователя; в) координационное число комплексообразователя;

 Получите свидетельство
Получите свидетельство Вход
Вход











 Комплексные соединения (1.47 MB)
Комплексные соединения (1.47 MB)
 0
0 918
918 6
6 Нравится
0
Нравится
0






