“Ko`rildi” O`IBDO`: _________ / __________________________________/ 201__ yil
| Sana |
|
|
|
|
| Sinf |
|
|
|
|
Darsning mavzusi: Molekular-kinetik nazariya haqida tushuncha
Darsning maqsadi :
Talimiy maqsad: O’quvchilarga molekular-kinetik nazariyasi haqida tushuncha berish.
Tarbiyaviy maqsad: O’quvchilarni onaVatanga muhabbat, milliy qadriyatlarimizga hurmat ruhida tarbiyalash, o’quvchilarni Vatan himoyachilari qilib tarbiyalashda kasbga yo’naltirish.
Rivоjlаntiruvchi mаqsаd: O’quvchilаrdа ilmiy dalillarni tahlil va sintez qilib xulosa chiqara olish qobiliyatini rivojlantirish. Ilmiy dunyoqаrаshni shаkllаntirish, o’quvchilarda texnikaga bo’lgan havas va qiziqishlarini yuksaltirish. Mustaqil bilim olish qobiliyatini rivojlantirish. Masala yechish malakasini qaror toptirish
Shakllantiriladigan kompetensiyalar:
-fizik atama, qonun,qoidalarni og’zaki va yozma bayon qila olish;
-ommaviy axborot vositalari orqali berilgan yangiliklarni gapirib bera olish;
-aniq hisob-kitob asosida masalalarni mustaqil tarzda yecha olish.
O`quv jaroyonining amalga oshirish texnologiyasi;
Uslubi: Noan`anaviy interfaol o`yinlardan foydalanish;
Shakli: Suhbat, musobaqa va hamkorlikda;
Nazorat:Og`zaki nazorat , savol- javoblar,muhokama, kuzatish, o`z- o`zini nazorat qilish;
Baholash: Rag`batlantirish ,5 balli tizim asosida baholash.
Dars materiallari va jihozlari:
Mavzuga oid ko’rgazmalijihozlar; Fizik olimlar portreti; Fizika darsligi va elektron shakli
Asosiy tushuncha va atamalar: modda; molekula; molekulyar-kinetik nazariya; modda tuzilishi;Broun harakati; turmushda va texnikada fizika.
Darsning blok-chizmasi
| № | Dars bosqichlari | Vaqt |
| 1 | Tashkiliy qism | 3 |
| 2 | O’tilgan mavzuni mustahkamlash | 10 |
| 3 | Yangi mavzu bayoni va fizik tajribalar o’tkazish | 20 |
| 4 | Darsni mustahkamlash | 5 |
| 5 | O’quvchilarni baholash | 5 |
| 6 | Uyga vazifa. | 2 |
Darsning borishi
1.Tashkiliy qism: O’quvchilarni darsga jalb qilish. Salomlashish. Yuqlama qilish. Dunyo yangiliklaridan xabardor qilish.
2.O’tilgan mavzuni mustahkamlash:6-8-sinfda o’tilgan mavzular bo’yicha suhbat o’tkazish.
3.Yangi mavzuning bayoni:
Molekular fizika va termodinamika moddaning turli agregat holatlaridagi fizik xossalarini, diffuziya, issiqlik o'tkazuvchanlik kabi hodisalarni, issiqlik ta'sirida modda holatining o'zgarishini, moddalarning issiqlik sig'imi, bug'lanislii, kondensatsiyasi, erishi, qotishi, mustahkamligi, elastikligi kabi xossalarini o'rganadi.
Moddalar nihoyatda ko'p zarralar - atom va molekulalardan tashkil topgan. Masalan, 1 sm3 hajmdagi qattiq jism yoki suyuqlikda 1021-1024 ta, normal sharoitdagi 1 sm3 havoda esa taxminan 1019 ta atom va molekula bo'ladi. Fizikaning «Mexanika» bo'limini o'rganishda jismlar zarralardan tuzilganligi e'tiborga olinmagan edi. «Molekular fizika va termodinamika» bo'limini o'rganishda esa jismlarni tashkil etgan moddalar atom va molekulalardan tuzilganligi o'rganiladi. Moddadagi ulkan sondagi har bir atom va molekulaning mexanik harakatini o'rganishning imkoni yo'q. Shu sababli bu muammoni hal etish uchun statistik va termodinamik metodlardan foydalaniladi.
Molekular-kinetik nazariyaning asosiy omillari
Moddalarda bo'ladigan issiqlik hodisalarini va bu moddalarning ichki xossalarini barcha moddalar tartibsiz harakat qiluvchi zarralardan iboratdir, deydigan tasawur asosida izohlaydigan nazariya molekular- kinetik nazariya deb ataladi.
Modda tuzilishining molekular-kinetik nazariyasi quyidagi omillarga asoslanadi:
Moddalar zarralardan — atom va molekulalardan tashkil topgan.
Atom va molekulalar to'xtovsiz va tartibsiz harakat qiladi.
Atom va molekulalar o'zaro ta'sirda bo'ladi.
Bu omillar gaz, suyuq va qattiq holatdagi moddalarda sodir bo'ladigan diffuziya hodisasida yaqqol namoyon bo'ladi.
1. Xonaning bir chekkasiga atir sepilsa, uning liidi xonaning boshqa chekkasiga yetib keladi. Bu hid, ya'ni atir molekulalardan tashkil topgan.
Atir molekulalari xona bo'ylab to'xtovsiz va tartibsiz harakatda bo'ladi.
Atir hidi bizga yetib kelguncha ma'lum vaqt o'tadi. Bunga sabab — atir molekulalari o'z yo'lida havodagi son-sanoqsiz molekulalar bilan to'qnashadi, ya'ni o'zaro ta'sirlashadi.
2. Stakandagi suv ustiga bir choy qoshiq sut quysak, suv bilan sut tezda aralashib ket- maydi (1-яrasm).Ularning aralashishiuchun ma'lum vaqt ketadi (1 - b rasm).

Suv va suyuqlikning o'zaro aralashishi ular zarralardan tashkil topganligi va bu zarralar to'xtovsiz va tartibsiz harakatda ekanligini ko'rsatadi. Aralashishiga vaqt ketishi esa zarra- laming o'zaro ta'sirlashishini ko'rsatadi.
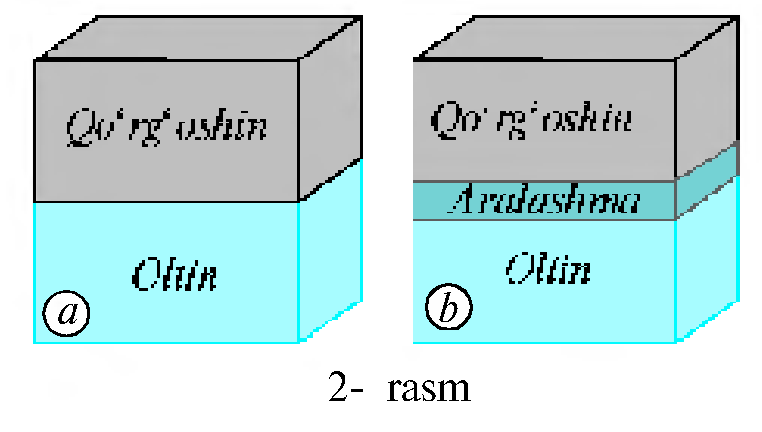
3. Oltin va qo'rg'oshin metallarining sirtlari silliqlanib, ustma-ust joylashtirilgan (2- a rasm). Metallar maxsus ravishda qisib qo'yilgan. Bir yildan keyin metallar qisqichdan olingan. Bunda metallar bir- biriga mustahkam yopishib qolganligi, oltin atomlari qo'rg'oshin moddasi ichiga, qo'rg'oshin atomlari esa oltin moddasi ichiga kirib borganligi ma'lum bo'lgan (2-b rasm).
Oltin va qo'rg'oshin moddalarining aralashishi ular zarralardan tashkil topganligi bu zarralar tartibsiz harakat qilishini, aralashishning sekin borishi esa metallarning zarralari o'zaro ta'sirlashishini ko'rsatadi.
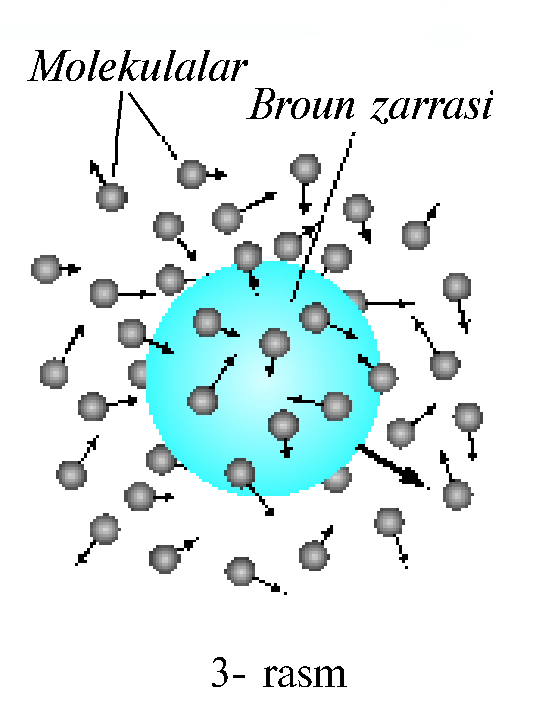
Broun harakati: Ingliz tabiatshunosi R. Broun1827- yilda mayda zarrachalarning harakatini o’rgangan.Suyuqlik yoki gazlarda zarraning to'xtovsiz va tartibsiz harakati xaotik harakat deb ataladi. «Xaotik» so'zi lotincha «xaos» so'zidan olingan bo'lib, «tartibsiz»degan ma'noni bildiradi. Zarralarning xaotik harakati R. Broun tomonidan kashf etilgani uchun u Broun harakati deb ham ataladi. Chang zarrasi — Broun zarrasining to'xtovsiz va tartibsiz harakat qilishining sababini tahlil qilaylik. Broun zarrasiga bir tomondan urilayotgan molekulalar soni boshqa tomondan urilayotgan molekulalar sonidan farq qiladi. Shu bilan birga, molekulalarning zarb kuchlari ham bir xil emas. Broun zarrasiga ta'sir etuvchi natijaviy kuch zarrani harakatlantiradi.
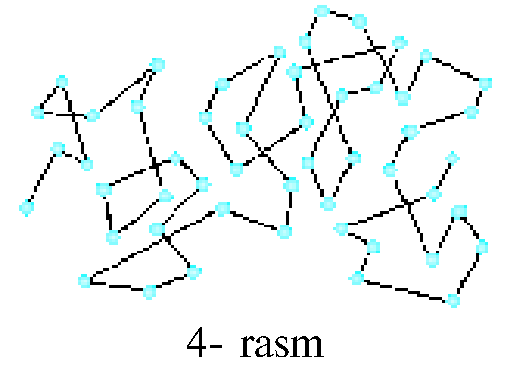
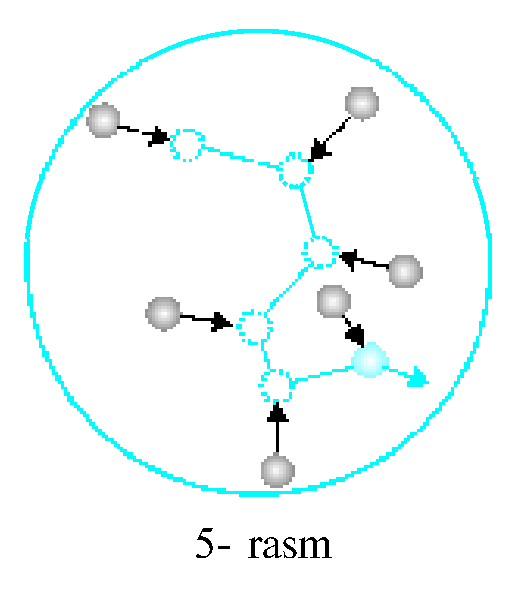
Molekulalar harakati tartibsiz bo'lgani uchun zarra harakat yo'nalishini uzoq davom ettira olmaydi. Birozdan keyin zarraga ta'sir etayotgan natijaviy kuch va uning yo'nalishi o'zgarishi natijasida Broun zarrasi o'z yo'nalishini o'zgartiradi. Bu jarayon to'xtovsiz davom etadi. Broun harakatini .Perren mukammal o'rga- nib, 1908—1913- yillarda xaotik harakat qilayotgan zarraning teng vaqtlar oralig'idagi holatlarini suratga olgan. Unda Broun zarrasining trayektoriyasi 4- rasmda tasvirlangandek turli uzunliklardagi siniq chiziqlardan iborat bo'lgan.Broun harakatini tevarak-atrofimizda ham kuza- tish mumkin. Masalan, Quyosh nurida havodagi chang zarralarining tinimsiz tartibsiz harakat qilayot- gani ko'rinadi.Gaz yoki suyuqlikdagi molekulaga boshqa molekulalar har tomondan tartibsiz urilib turadi. Natijada u goh bir tomonga, goh boshqa tomonga tinimsiz tartibsiz harakat qilishga majbur bo'ladi (5- rasm). Broun harakati molekulalarning tartibsiz harakat qilishidan tashqari, molekulalarning mavjudligini ham isbotlaydi.
“Koptok o’yini”
Bunda o’quvchilar bir joyga to’planib koptokni bir –birlariga otadilar. Bu o’yinni butun sinf bilan, agar dars shovqun bo’ladi desangiz 10 ta o’quvchi bilan o’ynash mumkin. Koptok o’yinini kuzatib xulosa chiqariladi. O’yinning ma’nosi shundan iboratki, bolalar molekula, koptok esa chang zarrachasi.

4.Darsni mustahkamlash uchun savollar:
a) Modda tuzilishining molekular-kinetik nazariyasi qanday omillarga asoslanadi?
b)Atir hidi tarqalishi misolida molekular-kinetik nazariyasiga oid omillarni qanday asoslash mumkin?
c)Sutning suvda aralashishiga oid tajribadan qanday xulosaga kelish mumkin?
d)Xaotik harakat deb qanday harakatga aytiladi?
5.Uyga vazifa: Darslikdagi 1-§ ni o’qib kelish va mavzu oxiridagi topshiriqlarni bajarish.
“Ko`rildi” O`IBDO`: _________ / __________________________________/ 201__ yil
| Sana |
|
|
|
|
| Sinf |
|
|
|
|
Darsning mavzusi: Molekulalarning o'lchami va massasi
Darsning maqsadi :
Ta’limiy maqsad:O’quvchilarga molekulalarning massasini, o‘lchamlarini va Avogadro sonini topishni o‘rgatish; modda miqdori va uning birligi; molyar massa haqida tushuncha berish.
Tarbiyaviy maqsad: O’quvchilarni onaVatanga muhabbat, milliy qadriyatlarimizga hurmat ruhida tarbiyalash, o’quvchilarni Vatan himoyachilari qilib tarbiyalashda kasbga yo’naltirish.
Rivоjlаntiruvchi mаqsаd: O’quvchilаrdа ilmiy dalillarni tahlil va sintez qilib xulosa chiqara olish qobiliyatini rivojlantirish. Ilmiy dunyoqаrаshni shаkllаntirish, o’quvchilarda texnikaga bo’lgan havas va qiziqishlarini yuksaltirish. Mustaqil bilim olish qobiliyatini rivojlantirish. Masala yechish malakasini qaror toptirish
Shakllantiriladigan kompetensiyalar:
-fizik atama, qonun,qoidalarni og’zaki va yozma bayon qila olish;
-ommaviy axborot vositalari orqali berilgan yangiliklarni gapirib bera olish;
-aniq hisob-kitob asosida masalalarni mustaqil tarzda yecha olish.
O`quv jaroyonining amalga oshirish texnologiyasi;
Uslubi: Noan`anaviy interfaol o`yinlardan foydalanish;
Shakli: Suhbat, musobaqa va hamkorlikda ishlash;
Nazorat:Og`zaki nazorat , savol- javoblar,muhokama, kuzatish, o`z- o`zini nazorat qilish;
Baholash: Rag`batlantirish ,5 balli tizim asosida baholash.
Dars materiallari va jihozlari:
Mavzuga oid ko’rgazmali jihozlar; Fizik olimlar portreti; Fizika darsligi
Asosiy tushuncha va atamalar: Avogadro doimiysi; modda miqdorining birligi - mol; molyar massa.
Darsning blok-chizmasi
| № | Dars bosqichlari | Vaqt |
| 1 | Tashkiliy qism | 3 |
| 2 | O’tilgan mavzuni mustahkamlash | 10 |
| 3 | Yangi mavzu bayoni va fizik tajribalar o’tkazish | 20 |
| 4 | Darsni mustahkamlash | 5 |
| 5 | O’quvchilarni baholash | 5 |
| 6 | Uyga vazifa. | 2 |
Darsning borishi
1.Tashkiliy qism: O’quvchilarni darsga jalb qilish. Salomlashish. Yo’qlama qilish. Dunyo yangiliklaridan xabardor qilish.
2.O’tilgan mavzuni mustahkamlash:
a) molekulyar-kinetik nazariyaning asosiy qonuniyatlarini aytib bering;
b) molekulalar mavjudligining o‘zingiz biladigan isbotlarini bayon eting;
c)1 sm3 hajmdagi yoki 1 gramm suvdagi molekulalar soni qancha?
d) molekuladan ham kichikroq zarracha bormi? U qanday nom bilan yuritiladi
3.Yangi mavzuning bayoni:
Molekulalarning o'lchami. Kimyo kursidan ma'lumki, molekulalar turlicha atom birikmalaridan tashkil topishi mumkin. Bir atomli (geliy He, argon Ar, neon Ne kabi inert gazlar), ikki atomli (kislorod O2, vodorod H2, azot N2 ) va ko'p atomli molekulalar bo'lishi mumkin. Turli modda atomlari birikib ko'p molekulalarni hosil qiladi. Masalan, osh tuzining molekulasi bitta natriy Na atomi va bitta xlor Cl atomidan, suv molekulasi esa ikkita vodorod H atomi va bitta kislorod O atomidan iborat (1-rasm). Hozirgi vaqtda turli usullar bilan atom va molekulalarning mavjudliginigina emas, balki ularning o'lchamlarini ham aniqlash mumkin. Masalan, suv sirtiga hajmi Vm= 10-9 m3 bo'lgan moy tomchisi tomizganimizda tomchi Sm=0,5 m2 yuzaga yoyilgan bo'lsin. U holda qatlamning qalinligi, ya'ni molekulaning diametri D quyidagicha topiladi: D=V/S
Molekulalarning soni. Molekulalarning o'lchami juda kichik bo'lgani uchun har qanday makroskopik jismda nihoyatda ko'p molekulalar bo'ladi. Bunga ishonch hosil qilish uchun massasi 10-3kg, hajmi V=10-6 m3 bo'lgan suv tomchisidagi molekulalar sonini taqriban hisoblab ko'raylik. Suv molekulasining diametri 3·10-10m ga teng ekanini hisobga olganimizda, har bir suv molekulasining egallagan hajmi taxminan V1»(3·10-10m)3 »2,7·10-29m3 ga to'g'ri keladi. U vaqtda 10-6m3 hajmdagi suv molekulalarining soni
![]() bo'ladi.
bo'ladi.
Molekulalarning massasi. Ayrim molekulalarning massasi juda kichik ekanligiga ishonch hosil qilish maqsadida bitta suv molekulasi massasini hisoblab ko'raylik. Buning uchun yuqorida normal sharoitda olingan 10-3kg massali suvning egallagan hajmi V= 10-6m3 ga tengligidan foydalanamiz. Bu hajmda mavjud bo'lgan suv molekulalarining soni N=3• 1022dona ekani ma'lum. U vaqtda 10-3 kg suv massasini unda mavjud bo'lgan molekulalar soniga bo'lish orqali bir dona suv molekulasining massasi topiladi:
![]()
Molekulalarning massalari juda kichik bo'lganligi tufayli, hisoblashlarda massalarning absolyut qiymatlaridan emas, balki nisbiy qiymatlaridan foydalanish qulaydir. Shuning uchun hamma atom va molekulalarning massasi Xalqaro kelishuvga muvofiq uglerod atomi massasining 1/12 qismi bilan taqqoslanadi. Buning sababi shundaki, uglerod ko'pgina kimyoviy birikmalar tarkibiga kirgani uchun uglerod massasi asos qilib olingan. Nisbiy molekulyar massa. Moddaning Mn nisbiy molekulyar (yoki atom) massasi deb shu molekula (yoki atom) massaning uglerod atomi mOCmassasining 1/12 qismiga nisbatiga aytiladi: Modda miqdori. Jismlarda atom yoki molekulalar nihoyatda ko'p bo'ladi. Shuning uchun aniq bir jismdagi atomlar sonini 0,012 kg uglerod massasidagi atomlar soni bilan taqqoslash qabul qilingan. Buning uchun modda miqdori deb ataladigan maxsus fizik kattalik kiritiladi. Modda miqdori (n) deb (grek harfi; "nyu" deb o'qiladi), ma'lum bir jismdagi molekulalar soni N ning 0,012 kg massali uglerodda mavjud bo'lgan atomlar soni (NA) ga nisbatiga aytiladi: Modda miqdori mol hisobida o'lchanadi. Bir mol — moddaning shunday miqdoriki, unda mavjud bo'lgan molekulalar soni 0,012 kg ugleroddagi atomlari soniga teng. Mol bilan bir qatorda katta o'lchamdagi modda miqdorini hisoblashda kilomol ham qo'llaniladi: 1 kmol=103 mol. Avogadro doimiysi. Molning ta'rifiga ko'ra, istalgan moddaning bir moldagi atomlar yoki molekulalar soni bir xil bo'ladi va shuning uchun uni Avogadro doimiysi deb ataladi. Bu 0,012 kg ugleroddagi atomlar soniga teng bo'lib, qiymat jihatidan NA=6,023·1023mol-1 ga teng. Molyar massa .Molyar massa molekulaning massasi bilan Avogadro doimiysining ko`paytmasiga teng: M=m0NA Har qanday miqdordagi moddaning massasini topish uchun bitta molekula massasini jismdagi molekulalar soniga ko'paytirish kerak: m=m0 N. Molyar massa tushunchasidan foydalanib, modda miqdorini quyidagicha aniqlash mumkin: ν=m/M m — moddaning massasi, M— molyar massa. Modda miqdori modda massasining uning molyar massasiga nisbatiga teng
4. Darsni mustahkamlash.
“Molekula atom” o’yini
Barcha sinf o’quvchilari bilan o’yin o’tkaziladi. (Agar shovqin bo’ladi desangiz 10 ta bola bilan o’yinni tashkil eting.) Bolalarga “atom” deb xitob qilinsa ular tartibsiz harakat qiladilar. Agar “suv molekulasi” deyilsa 3 ta o’quvchi birlashishi lozim. Yana “Atom” “Atom” “Atom” deb, “ vodorod molekulasi “- deb aytilsa 2 ta bola birlashib vodorod molekulasini hosil qiladilar . Agar “ kislorod molekulasi “- deyilsa u holda 2 ta bola birlashib kislorod molekulasini hosil qiladi. O’yin davomida bironta o’quvchi birlashmasdan bir o’zi qolsa undan o’z mahoratini ko’rsatish talab etiladi.(Mahorati deganda fizika faniga oid she’r, topishmoqlar aytish tushuniladi)
a) Juda kichkina suv tomchisining massasi 10 -10 g. Tomchi nechta molekuladan tashkil topgan?
b) Ozon (O3) ning bitta molekulasining massasini hisoblang.
5.Uyga vazifa: Darslikdagi 2-§ ni o’qib kelish va mavzu oxiridagi topshiriqlarni bajarish;
Karbonat angidrid (CO2 ) bitta molekulasining massasini hisoblash.


 Получите свидетельство
Получите свидетельство Вход
Вход












 Fizika fanidan eng yaxshi dars ishlanma uchun taqdirlandi (1.83 MB)
Fizika fanidan eng yaxshi dars ishlanma uchun taqdirlandi (1.83 MB)
 0
0 568
568 0
0 Нравится
0
Нравится
0


