Занятие №44.
ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ.
Цели занятия:
Образовательные: формирование знаний о природе электрического тока в газах и полупроводниках; представлений о самостоятельном и несамостоятельном газовом разряде, плазме; практическом использовании тока в газах.
Развивающие: продолжить работу по овладению методами научного познания, развивать интеллектуальные умения учащихся (наблюдать, сравнивать, анализировать, делать выводы), творческие способности.
Воспитательные: продолжить формирование научного мировоззрения, интереса к физике, воспитывать умение работать организованно, в творческих группах.
Тип занятия: изучение нового материала.
Форма организации познавательной деятельности учащихся: фронтальная, групповая.
Основной методологический подход к организации учебного процесса на занятии: коммуникативный.
ПЛАН ЗАНЯТИЯ
Организационный момент
Проверка домашнего задания
Актуализация опорных знаний
Целеполагание
Изучение нового материала
Домашнее задание
Рефлексия
Организационный момент. Приветствие учащихся, проверка
готовности учащихся к занятию.
Проверка домашнего задания.
Упр. 19 (1).

Дано: Решение:
 = 0,0
= 0,0  При нагревании алюминиевого проводника
При нагревании алюминиевого проводника
 = 20
= 20  его удельное сопротивление вследствие
его удельное сопротивление вследствие
 = 2,8
= 2,8 
 Ом
Ом  м движения частиц изменяется по закону:
м движения частиц изменяется по закону:

 = 4,2
= 4,2 


 =
=  ( 1 +
( 1 + 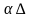 t).
t).
 – ? Откуда удельное сопротивление при нулевой
– ? Откуда удельное сопротивление при нулевой
температуре:  =
=  .
.
 =
=  = 2,58
= 2,58 
 (Ом
(Ом  м).
м).
Ответ:  = 2,58
= 2,58 
 (Ом
(Ом  м).
м).
Актуализация опорных знаний.
– Какова природа электрического тока в металлах? (Электрический ток
в металлах представляет собой упорядоченное движение свободных электронов).
– Как изменяется сопротивление проводника при повышении температуры? (Сопротивление металлического проводника возрастает с увеличением температуры: R = ( 1 +
)/
Что называют температурным коэффициентом сопротивления?
(Температурный коэффициент сопротивления численно равен относительному приращению удельного сопротивления проводника при приращении его температуры на 1К:  =
= ).
– В чем проявляется явление сверхпроводимости? (Состояние, при котором электрическое сопротивление проводника, обращается в нуль, называют сверхпроводимостью, а сам проводник – сверхпроводником).
Целеполагание. Цель данного занятия: сформировать знания о
природе электрического тока в газах и полупроводниках; представления о самостоятельном и несамостоятельном газовом разряде, плазме; практическом использовании тока в газах.
Изучение нового материала.
Вы уже знаете, что в металлах перенос заряда не сопровождается
переносом вещества, а носителями свободных зарядов являются электроны. Но существует класс проводников, прохождение электрического тока в которых всегда сопровождается химическими изменениями и переносом вещества. Такими проводниками являются растворы многих солей, кислот и щелочей, а также расплавы солей и оксидов металлов.
Природа электрического тока в электролитах. Вещества, растворы или расплавы которых проводят электрический ток, называют электролитами.
Соберём электрическую цепь, состоящую из источника тока, лампы накаливания и ванны с дистиллированной водой, в которой находятся два угольных электрода (рис. 1). При замыкании цепи лампа светиться не будет, следовательно, дистиллированная вода не проводит электрический ток. Повторим опыт, добавив в дистиллированную воду сахар. Лампа не светится и в этом случае. Раствор сахара в воде также не является проводником. А теперь добавим в дистиллированную воду небольшое количество соли, например, хлорида меди(II) Cu . В цепи проходит электрический ток, о чём наглядно свидетельствует свечение лампы. Следовательно, раствор соли в воде является проводником электрического тока, т. е. при растворении хлорида меди(II) в дистиллированной воде появились свободные
носители электрического заряда.
Рис. 1
Изучая химию, вы узнали, что при растворении солей, кислот и щелочей в воде происходит электролитическая диссоциация, т. е. распад молекул электролита на ионы.
В проведенном опыте хлорид меди (II) Cu в водном растворе диссоциирует на положительно заряженные ионы меди
и отрицательно заряженные ионы хлора
:
Cu
+ 2
.
Ионы и
в растворе при отсутствии электрического поля движутся хаотически. Под действием внешнего электрического поля на хаотическое движение частиц накладывается направленное движение положительно и отрицательно заряженных ионов (рис. 2). При этом положительно заряженные ионы
движутся к электроду, подключённому к отрицательному полюсу источника тока (катоду), отрицательно заряженные ионы
– к электроду, подключенному к положительному полюсу источника тока (аноду). На аноде будет происходить процесс окисления ионов
до атомов хлора:
–
= Cl.
Рис. 2
Нейтральные атомы хлора образуют молекулы хлора, который выделяется на аноде:
2Cl = .
На катоде будет происходить процесс восстановления ионов до нейтральных атомов и осаждение металлической меди:
+ 2
= Cu.
Таким образом, свободными носителями электрического заряда в электролитах являются положительно и отрицательно заряженные ионы, образующиеся в результате электролитической диссоциации, а проводимость электролитов в отличие от проводимости металлов является ионной. Электролиты относят к проводникам второго рода.
Сопротивление электролитов. Для изучения сопротивления электролитов соберем электрическую цепь, состоящую из источника тока, электролитической ванны и амперметра (рис. 3).
Рис. 3
Поддерживая постоянное напряжение между электродами, приблизим их друг к другу. Амперметр покажет увеличение силы тока в цепи. Таким образом, при уменьшении расстояния между электродами сопротивление электролита уменьшается.
Поместим один из электродов в электролит так, чтобы часть его выступала над поверхностью раствора. Показание амперметра уменьшится. Отсюда следует, что при уменьшении площади перекрытия электродов в
электролите его сопротивление увеличивается.
Нагреем электролит на электрической плитке. Амперметр покажет увеличение силы тока в цепи. Следовательно, при увеличении температуры сопротивление электролита уменьшается.
Будем увеличивать напряжение между электродами в 2, 3, ..., п раз.
Показания амперметра увеличиваются, причём сила тока в электролите изменяется прямо пропорционально напряжению, т. е. для электролитов выполняется закон Ома I = .
Следует отметить, что при прохождении электрического тока через электролит проявляется тепловое действие тока, т. е. выполняется закон Джоуля – Ленца Q = t.
Законы электролиза Фарадея. Процесс выделения на электроде вещества, связанный с окислительно – восстановительными реакциями, протекающими при прохождении электрического тока через растворы (расплавы) электролитов, называют электролизом.
Первый закон электролиза был экспериментально установлен Фарадеем в 1833 г.
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m = kq. (1)
Коэффициент пропорциональности k называют электрохимическим эквивалентом данного вещества. Он численно равен массе вещества, выделившегося на одном из электродов при прохождении через электролит единичного электрического заряда. В СИ электрохимический эквивалент измеряют в килограммах на кулон .
Поскольку q = It, где I – сила тока, t – промежуток времени прохождения тока через электролит, то
m = kIt.
Массу вещества, выделившегося на электроде при прохождении через электролит электрического заряда q, можно определить, зная массу одного иона и число N осевших на этом электроде ионов:
m = N,
=
,
где М – молярная масса вещества, – постоянная Авогадро.
Тогда число ионов N = =
.
С другой стороны, число ионов, нейтрализовавшихся на электроде:
N = ,
где – заряд одного иона. Так как заряд иона
кратен элементарному заряду e, то
= en, где n – валентность иона.
Значит, =
и m =
q. (2)
Сравнивая формулы (1) и (2), получим
k = (3)
Так как и e – универсальные постоянные, то физическую величину F =
e = 9,65

в честь М. Фарадея назвали постоянной Фарадея.
Таким образом, формулу (3) для определения электрохимического эквивалента вещества можно записать в виде
k = .
Отношение = x называют химическим эквивалентом вещества. Тогда
k = .
Фарадеем был сформулирован закон, называемый вторым законом электролиза, который устанавливает связь между электрохимическим и химическим эквивалентами вещества: электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам: =
.
Техническое применение электролиза (самостоятельно).
ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
Газы при нормальных условиях не проводят электрический ток, т. е. являются диэлектриками. Это обусловлено тем, что газы состоят из нейтральных атомов (молекул). Однако при определенных условиях газы, в том числе и воздух, становятся проводниками.
Природа электрического тока в газах. Проведём опыт, позволяющий
продемонстрировать изменение электрической проводимости газа (воздуха).
Два металлических диска, заряженные разноимёнными зарядами и расположенные на некотором расстоянии друг от друга, соединим с электрометром (рис. 4). Стрелка электрометра при этом отклонится на некоторый угол. Электрометр не разряжается, значит, при небольшой разности потенциалов между дисками воздух не проводит электрический ток.
Повторим опыт, нагревая пламенем (спиртовки, свечи) воздушный промежуток между дисками. Электрометр разряжается, т. е. через воздух проходит электрический ток (рис. 5). Вывод очевиден: в воздушном промежутке между дисками появились свободные носители электрического заряда.
Рис. 4 Рис. 5
Если убрать пламя, то электрический ток исчезнет, т. е. воздух между дисками опять станет диэлектриком.
Объясним результаты рассмотренного опыта. Нагревание газа пламенем приводит к образованию свободных электронов и положительно заряженных ионов. Процесс, в результате которого некоторые атомы (молекулы) газа теряют электроны и превращаются в положительно заряженные ионы, называют ионизацией газа. Минимальное значение энергии, необходимой для отрыва электрона от атома (молекулы), называют энергией ионизации атома (молекулы). Наряду с ионизацией может происходить присоединение образовавшихся при отрыве электронов к нейтральным атомам (молекулам) газа. Это приводит к образованию отрицательно заряженных ионов.
Под действием электрического поля в газе возникает направленное движение положительно заряженных ионов к отрицательному электроду (катоду) и направленное движение электронов и отрицательно заряженных ионов к положительному электроду (аноду). Таким образом, носителями электрического заряда в ионизированных газах являются положительно и отрицательно заряженные ионы и свободные электроны. Следовательно, проводимость газов – ионно – электронная. Прохождение электрического тока через ионизированный газ называют газовым разрядом.
После прекращения внешнего воздействия (в данном случае, нагревания пламенем) электрический ток в газе прекращается. Это обусловлено тем, что при столкновении положительно заряженного иона с электроном они образуют нейтральный атом (молекулу) газа. Ионы разных знаков при столкновении также превращаются в нейтральные атомы (молекулы). Эти процессы называют рекомбинацией ионов. При рекомбинации освобождается энергия, равная энергии, затраченной на ионизацию.
Таким образом, для того чтобы в газе появились свободные носители электрического заряда, его атомы (молекулы) необходимо ионизировать. Это можно осуществить нагреванием газа до высокой температуры, воздействием на газ ультрафиолетовым, рентгеновским, радиоактивным излучениями и др.
Внешние воздействия, в результате которых происходит ионизация, называют ионизаторами. Разряд, возникающий в результате ионизации газа под действием внешнего ионизатора, называют несамостоятельным.
Вольт – амперная характеристика газового разряда. Для изучения разряда в газе удобно использовать стеклянную трубку с двумя электродами. Рассмотрим зависимость силы тока в газе от напряжения, приложенного к электродам трубки, – вольт – амперную характеристику газового разряда (рис. 6).
Рис. 6
В результате действия внешнего ионизатора происходит ионизация газа в пространстве между электродами. Одновременно с этим происходит и обратный процесс – превращение ионов в нейтральные атомы (молекулы). При небольшом напряжении между электродами незначительное количество образовавшихся ионов и электронов достигает электродов, создавая электрический ток. Большинство ионов рекомбинируют, не успевая достигнуть электродов. При увеличении напряжения между электродами возрастает количество заряженных частиц, достигших электродов, т. е.
сила тока увеличивается. При этом сила тока прямо пропорциональна приложенному напряжению, т. е. выполняется закон Ома (участок графика АВ).
При дальнейшем повышении напряжения пропорциональность нарушается (участок графика ВС). Начиная с некоторого значения напряжения (точка С) все носители электрического заряда, образовавшиеся под действием ионизатора, достигают электродов, не успев рекомбинировать. При этом сила тока принимает максимальное значение и не зависит от напряжения (участок графика СD). Электрический ток, сила которого не зависит от напряжения, называют током насыщения.
При достаточно высоком напряжении свободные электроны под действием электрического поля ускоряются и приобретают кинетическую энергию, достаточную для ионизации атомов (молекул) газа при соударении с ними. Процесс отрыва от атома (молекулы) газа одного или нескольких электронов,
вызванный столкновением с этими атомами (молекулами) свободных электронов, называют ионизацией электронным ударом. Возникшие в результате ударной ионизации свободные электроны ускоряются электрическим полем и вызывают ионизацию новых частиц. Такие свободные электроны являются вторичным ионизатором. Это ведёт к лавинообразному нарастанию числа вторичных свободных электронов и положительно заряженных ионов (рис. 7), а значит, и к увеличению силы разрядного тока.
Рис. 7
Однако сам разряд всё ещё остаётся несамостоятельным, так как после прекращения действия внешнего ионизатора он продолжается только до тех пор, пока отрицательно заряженные ионы и все электроны (первичные и вторичные) не достигнут анода, а положительно заряженные ионы – катода. Несамостоятельному лавинному разряду в газе соответствует участок графика DЕ на рисунке 6.
Однако в ряде случаев газовый разряд может существовать и после прекращения действия внешнего ионизатора. В этом случае имеющееся между электродами сильное электрическое поле является причиной сохранения газового разряда, который называют самостоятельным.
Для возникновения самостоятельного разряда недостаточно наличия одного лишь процесса ударной ионизации. Для поддержания разряда необходимо, чтобы в газе постоянно возникали носители электрического заряда без действия внешнего ионизатора. При движении положительно заряженных ионов к катоду их кинетическая энергия под действием поля увеличивается. Если энергия ионов достаточно велика, то при ударе о катод они могут выбивать с поверхности катода электроны. Этот процесс называют вторичной электронной эмиссией («эмиссия» означает «испускание»). При бомбардировке положительно заряженными ионами катода происходит его нагревание. При высокой температуре катода с его поверхности происходит испускание электронов. Такой процесс называют термоэлектронной эмиссией. В результате этих процессов в газе создаётся значительное число свободных электронов. В зависимости от давления газа, его температуры и напряжённости электрического поля вторичная электронная эмиссия и термоэлектронная эмиссия могут происходить одновременно (участок графика ЕК на рисунке 6). Таким образом, в отсутствие внешнего ионизатора самостоятельный разряд будет поддерживаться за счёт вторичной электронной эмиссии и (или) термоэлектронной эмиссии с поверхности катода.
Виды самостоятельного газового разряда и их применение (самостоятельно).
Плазма (самостоятельно).
Домашнее задание. § 25 – 26, упр. 20 (1).
Рефлексия.
3

 Получите свидетельство
Получите свидетельство Вход
Вход












 Электрический ток в электролитах. электрический ток в газах (180.08 KB)
Электрический ток в электролитах. электрический ток в газах (180.08 KB)
 0
0 326
326 5
5 Нравится
0
Нравится
0


