Пояснительная записка
Экзаменационные билеты по химии устной итоговой аттестации учащихся 8 класса составлены на основе государственного стандарта химического образования.
Основная цель: проверить выполнение государственного стандарта уровня подготовки учащихся.
Главные задачи: выявить подготовку химически и экологически грамотной личности, понимающей, что жизнь – это наивысшая ценность, овладевшей химическим и экологическим мышлением, освоившей основы химической культуры, овладевшей необходимыми методами изучения окружающих веществ, умеющей их применять на практике: ведения здорового образа жизни, охраны окружающей среды.
Требования к уровню подготовленности:
Знать / понимать
• химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
• важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
• основные законы химии: сохранения массы веществ, постоянства состава, периодический закон.
Уметь
называть: химические элементы, соединения изученных классов;
• объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов
и главных подгрупп; сущность реакций ионного обмена;
• характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов;
связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
• определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
• составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций;
• обращаться с химической посудой и лабораторным оборудованием;
• распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид -, сульфат -, карбонат - ионы;
• вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции.
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
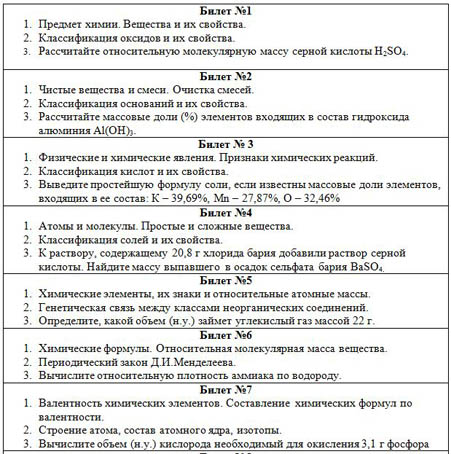
Весь материал - смотрите документ.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Экзаменационные билеты по химии (8 класс) (24.08 КB)
Экзаменационные билеты по химии (8 класс) (24.08 КB)
 4
4 21876
21876 890
890











а ответы есть?
А есть ответы на эти билеты
ок хорошо