
Алкены (олефины):
строение, изомерия, свойства, получение и применение
учитель химии МБОУ школы с. Анучино
Новикова Е.В.
Вопросы
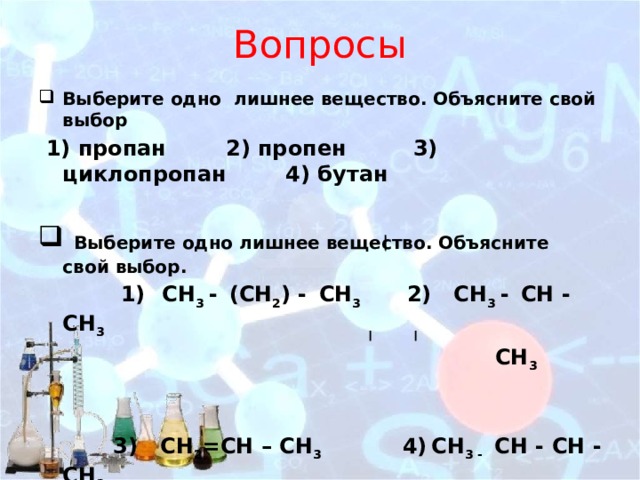
- Выберите одно лишнее вещество. Объясните свой выбор
1) пропан 2) пропен 3) циклопропан 4) бутан
- Выберите одно лишнее вещество. Объясните свой выбор.
1) СН 3 - (СН 2 ) - СН 3 2) СH 3 - CН - СH 3
СН 3
3) СН 2 =СН – СН 3 4) СH 3 - CН - CН - СH 3
CH 3 CH 3
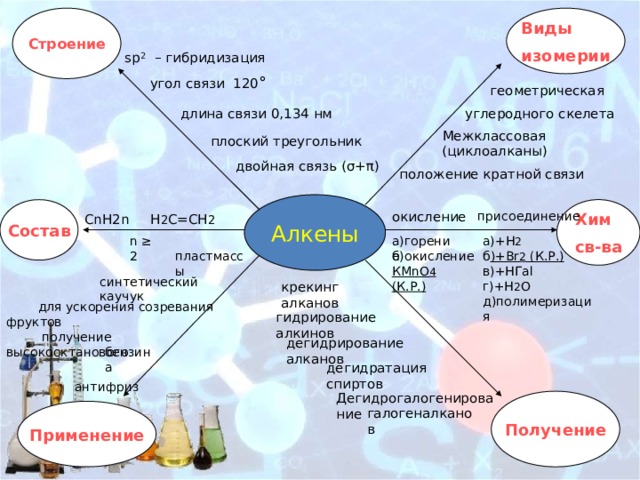
Строение
Виды
изомерии
sp 2 – гибридизация
угол связи 120 °
геометрическая
углеродного скелета
длина связи 0,134 нм
Межклассовая
плоский треугольник
(циклоалканы)
двойная связь (σ+π)
положение кратной связи
Алкены
Хим
Состав
св-ва
СnН2n H 2 C=CH 2
присоединение
окисление
а)+Н 2
а)горение
n ≥ 2
пластмассы
б )+Вr 2 (К.Р.)
б)окисление
в)+HГal
КМnО 4 (К.Р.)
синтетический каучук
г)+Н 2 О
крекинг алканов
д)полимеризация
для ускорения созревания фруктов
гидрирование алкинов
получение высокооктанового
дегидрирование алканов
бензина
дегидратация спиртов
антифриз
Дегидрогалогенирование
Получение
Применение
галогеналканов
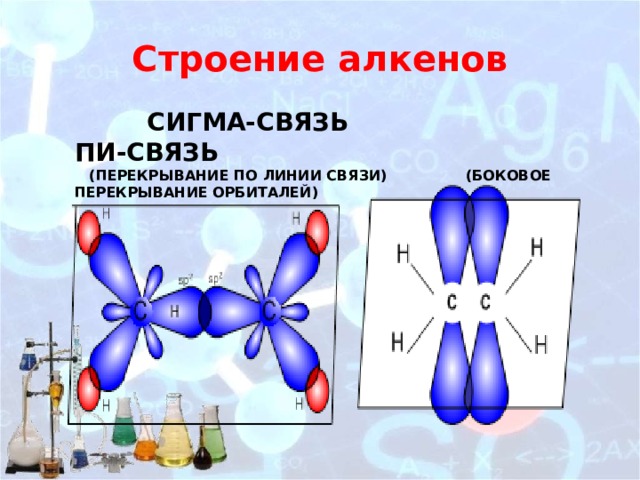
Строение алкенов
сигма-связь пи-связь (перекрывание по линии связи) (боковое перекрывание орбиталей)
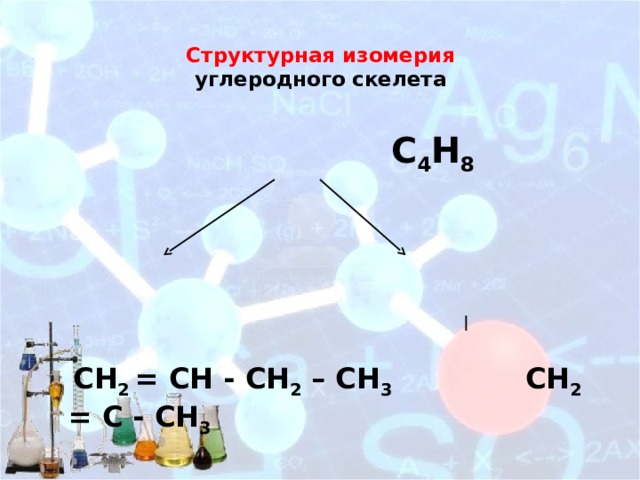
Структурная изомерия углеродного скелета
С 4 Н 8
СН 2 = СН - СН 2 – СН 3 СH 2 = C - CH 3
Бутен-1 CH 3
2-метилпропен
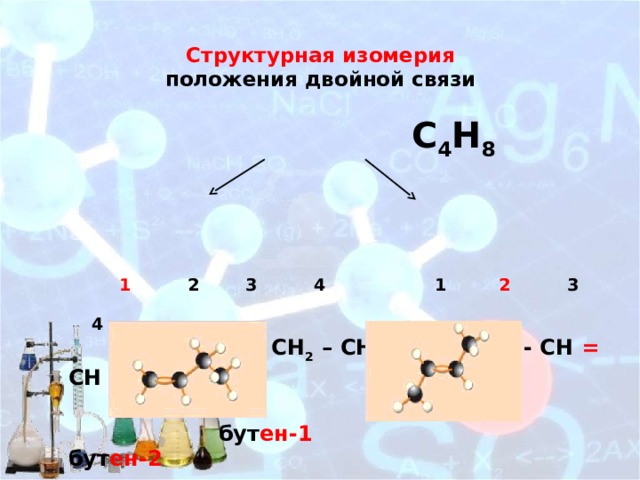
Структурная изомерия положения двойной связи
С 4 Н 8
1 2 3 4 1 2 3 4
СН 2 = СН - СН 2 – СН 3 СН 3 - СН = СН – СН 3
бут ен-1 бут ен-2
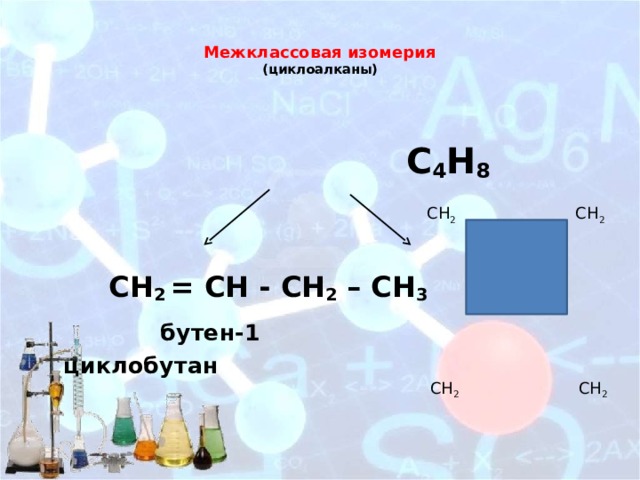
Межклассовая изомерия (циклоалканы)
С 4 Н 8
СН 2 = СН - СН 2 – СН 3
бутен-1 циклобутан
СН 2 СН 2
СН 2 СН 2

Химические свойства I. реакции присоединения
1. гидрирование (+Н-Н)
СН 2 =СН 2 +Н 2 → СН 3 -СН 3
этилен этан
2. Галогенирование (+Cl 2 ; Br 2 ( качественная р-ция ))
СН 2 =СН 2 +Br 2 → СН 2 Br - СН 2 Br
этилен 1,2-дибромэтан

Химические свойства I. реакции присоединения
Присоединение по правилу Марковникова
Водород присоединяется к наиболее гидрогенизированному атому углерода, а атом галогена к – наименее гидрогенезированному атому углерода
3. Гидрогалогенирование (+HCl)
СН 2 = С Н – СН 3 +Н- Cl → СН 3 –ClСН – СН 3
пропен 2-хлорпропан
4. Гидратация (+H 2 O)
СН 2 = С Н – СН 3 +Н- OH → СН 3 –СНOH – СН 3
пропен пропанол-2
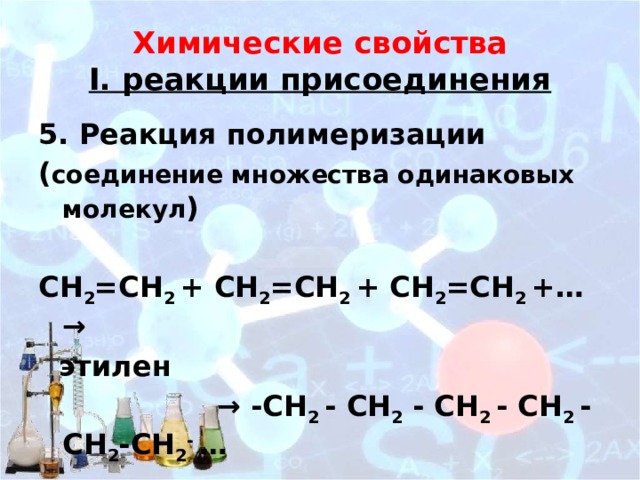
Химические свойства I. реакции присоединения
5. Реакция полимеризации
( соединение множества одинаковых молекул )
СН 2 =СН 2 + СН 2 =СН 2 + СН 2 =СН 2 +…→
этилен
→ -СН 2 - СН 2 - СН 2 - СН 2 - СН 2 -СН 2 - …
полиэтилен
![Химические свойства II. Реакции окисления А) горение С 2 Н 4 +3О 2 → 2СО 2 +2Н 2 О Б) окисление перманганатом калия. Качественная реакция на П-связь . СН 2 =СН 2 + Н-ОН+[О] → CH 2 – CH 2 этилен OH OH этиленгликоль Происходит обесцвечивание раствора](https://fsd.videouroki.net/html/2020/11/19/v_5fb65300e9659/img10.jpg)
Химические свойства II. Реакции окисления
А) горение С 2 Н 4 +3О 2 → 2СО 2 +2Н 2 О
Б) окисление перманганатом калия. Качественная реакция на П-связь .
СН 2 =СН 2 + Н-ОН+[О] → CH 2 – CH 2
этилен OH OH
этиленгликоль
Происходит обесцвечивание раствора

Получение алкенов В лаборатории
1) Дегидратация этилового спирта ( отщепление воды в присутствии Н 2 SO 4 )
C H 3 – CH 2 – OH CH 2 = CH 2 + H 2 O
2) Дегидрогалогенирование
(отщепление галогеноводородов) (правило Зайцева)
При отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода
H 2 SO 4 , 140-150 0 C
cпирт, t
СН 3 – СН 2 – СНBr – CH 3 + NaOH СН 3 – СН = СН – CH 3 + NaBr + H 2 O

Получение алкенов В промышленности
1) Крекинг алканов
C 8 H 18 → C 4 H 10 + C 4 H 8
алкан алкан алкен
C 4 H 10 → C 2 H 6 + C 2 H 4
алкан алкан алкен
t
t

Применение алкенов
полиэтилен растворители
пластмассы получение спирта

Применение алкенов
антифриз тормозная жидкость
бензин с высоким для созревания
октановым числом фруктов (этилен)

Домашнее задание
Прочитать §-8,9
- Решить задачу:
Найти молекулярную формулу алкена, относительная плотность которого по кислороду равна 1,75.
- Осуществить цепочку превращения
С 2 Н 6 → С 2 Н 4 → С 2 Н 5 Br → C 2 H 4 → C 2 H 5 OH → CO 2

литература
- 1. Рудзитис Г. Е., Фельдман Ф. Г. Химия. 10 класс. М.:Просвещение,2013
- 2. Кузнецова Н. Е., Титова И. М., Гара Н. Н. Химия. 10 класс. М.: Издательский центр “Вентана-Граф”, 2005.
- 3. Физические свойства алкенов ЭОР ОМС
- Картинки
- https://yandex.ru/images/search?source=wiz&img_url=http%3A%2F%2Fmognovse.ru%2Fmogno%2F662%2F661371%2F661371_html_45d6615a.png&p=14&text=%D1%81%D1%82%D1%80%D0%BE%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B0%D0%BB%D0%BA%D0%B5%D0%BD%D0%BE%D0%B2%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8&noreask=1&pos=294& rpt=simage&lr=10942
- Картинки https://yandex.ru/images/search?source=wiz&img_url=http%3A%2F%2Fwww.rawpedagogy.ru%2Fimages%2Fbooks%2F389%2Fimage043.png&p=8&text=%D1%81%D1%82%D1%80%D0%BE%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B0%D0%BB%D0%BA%D0%B5%D0%BD%D0%BE%D0%B2%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8&noreask=1&pos=176&rpt=simage&lr=10942

 Получите свидетельство
Получите свидетельство Вход
Вход











 Алкены (олефины) (796.07 KB)
Алкены (олефины) (796.07 KB)
 0
0 444
444 8
8 Нравится
0
Нравится
0


