
Алкены
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ

АЛКЕНЫ
Углеводороды, в молекулах которых содержится одна двойная углерод-углеродная связь, называют этиленовыми углеводородами , или алканами

АЛКЕНЫ
Характеристика двойной связи (С ═ С)
Вид гибридизации –
Валентный угол –
Длина связи С = С –
Строение –
Вид связи –
По типу перекрывания –
sp 2
120 0
0,134 нм
плоскостное
ковалентная неполярная
σ и π
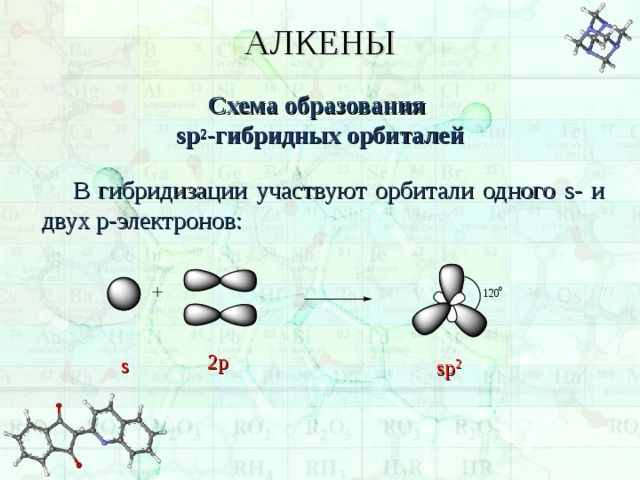
АЛКЕНЫ
Схема образования sp 2 -гибридных орбиталей
В гибридизации участвуют орбитали одного s - и двух p -электронов:
2p
s
sp 2

АЛКЕНЫ
Гомологический ряд
Общая формула С n Н 2n
C 2 H 4
C 3 H 6
C 4 H 8
C 5 H 10
C 6 H 12
C 7 H 14
Эт ен
Проп ен
Бут ен
Пент ен
Гекс ен
Гепт ен
- Эт ен Проп ен Бут ен Пент ен Гекс ен Гепт ен
- Эт ен Проп ен Бут ен Пент ен Гекс ен Гепт ен
- Эт ен Проп ен Бут ен Пент ен Гекс ен Гепт ен
- Эт ен Проп ен Бут ен Пент ен Гекс ен Гепт ен

АЛКЕНЫ
Изомерия
Возможны два типа изомерии:
структурная изомерия :
- углеродного скелета
- положения двойной связи
- межклассовая
пространственная изомерия:
- геометрическая
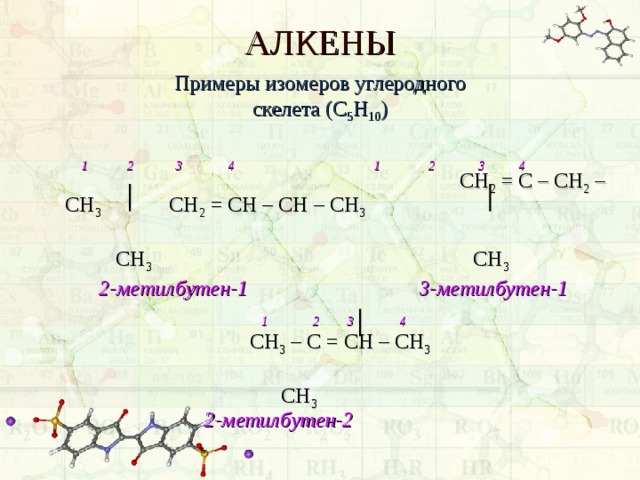
АЛКЕНЫ
Примеры изомеров углеродного скелета (С 5 Н 10 )
1 2 3 4 1 2 3 4 СН 2 = С – СН 2 – СН 3 СН 2 = СН – СН – СН 3
СН 3 СН 3
2-метилбутен-1 3-метилбутен-1
1 2 3 4
СН 3 – С = СН – СН 3
СН 3 2-метилбутен-2
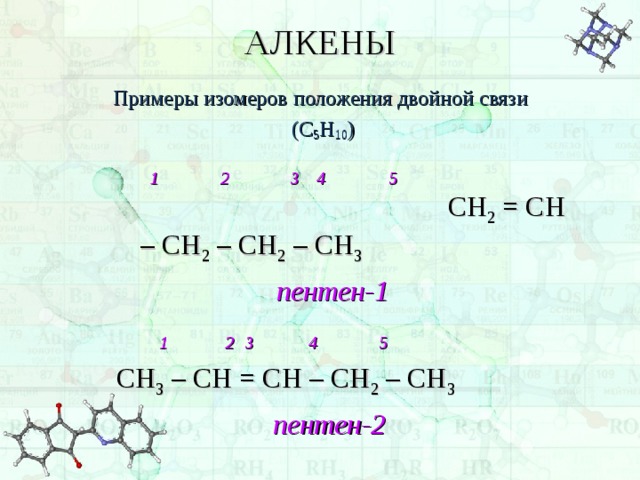
АЛКЕНЫ
Примеры изомеров положения двойной связи
(С 5 Н 10 )
1 2 3 4 5 СН 2 = СН – СН 2 – СН 2 – СН 3
пентен-1
1 2 3 4 5
СН 3 – СН = СН – СН 2 – СН 3
пентен-2
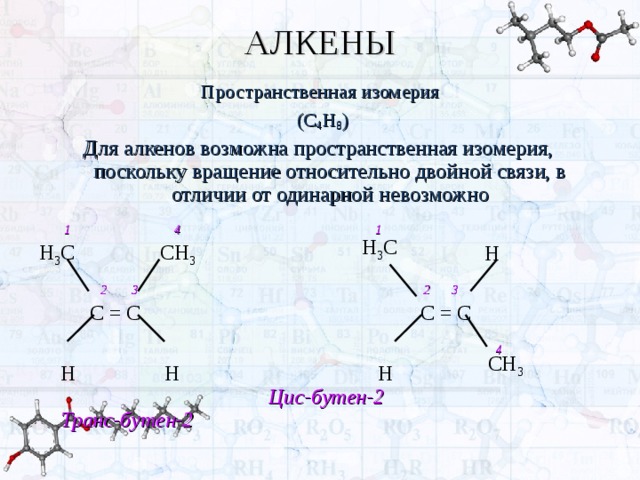
АЛКЕНЫ
Пространственная изомерия
(С 4 Н 8 )
Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной связи, в отличии от одинарной невозможно
1 4 1
Н
2 3 2 3
С = С С = С
4
Н Н Н Цис-бутен-2 Транс-бутен-2
Н 3 С
Н 3 С
СН 3
СН 3
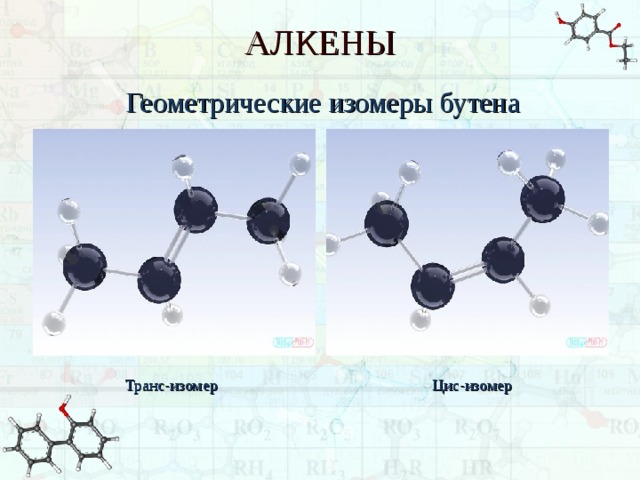
АЛКЕНЫ
Геометрические изомеры бутена
Транс-изомер
Цис-изомер
АЛКЕНЫ
Физические свойства алкенов
- Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях
- С 2 – С 4 - газы
- С 5 – С 16 - жидкости
- С 17 … - твёрдые вещества
- С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ

АЛКЕНЫ
Химические свойства алкенов
По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества, что обусловлено наличием двойной связи, состоящей из σ - и π -связей. Алкены способны присоединять два одновалентных атома или радикала за счёт разрыва π -связи, как менее прочной

АЛКЕНЫ
Типы химических реакций, характерные для алкенов
- Реакции присоединения
- Реакции полимеризации
- Реакции окисления
АЛКЕНЫ
Реакции присоединения
1. Гидрирование
C Н 2 = СН 2 + Н 2 СН 3 – СН 3
этен этан
Условия реакции : катализатор – Ni, Pt, Pd
2. Галогенирование
1 2 3
C Н 2 = СН – СН 3 + С l – С l СН 2 – СН – СН 3
пропен
Cl Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях
АЛКЕНЫ
Реакции присоединения
3. Гидрогалогенирование
1 2 3 4 1 2 3 4
СН 2 = СН – СН 2 – СН 3 + Н – С l C Н 3 – СН – СН 2 – СН 3
Бутен-1 Cl
2-хлорбутан
4. Гидратация
1 2 3 1 2 3
C Н 2 = СН – СН 3 + Н – ОН СН 3 – СН – СН 3
пропен
ОН
пропанол-2
Условия реакции : катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
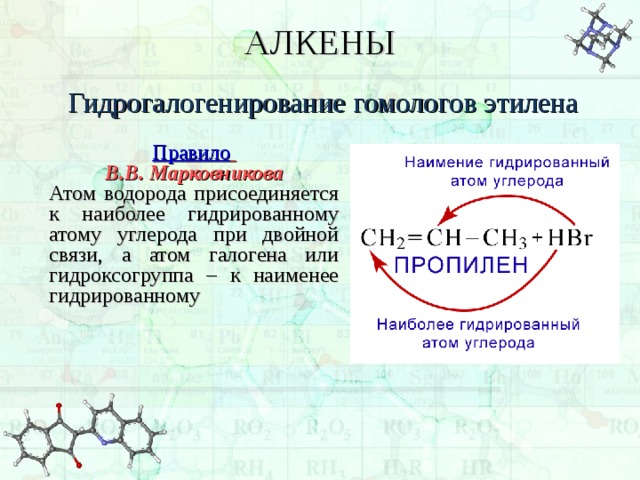
АЛКЕНЫ
Гидрогалогенирование гомологов этилена
Правило
В.В. Марковникова
Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи, а атом галогена или гидроксогруппа – к наименее гидрированному
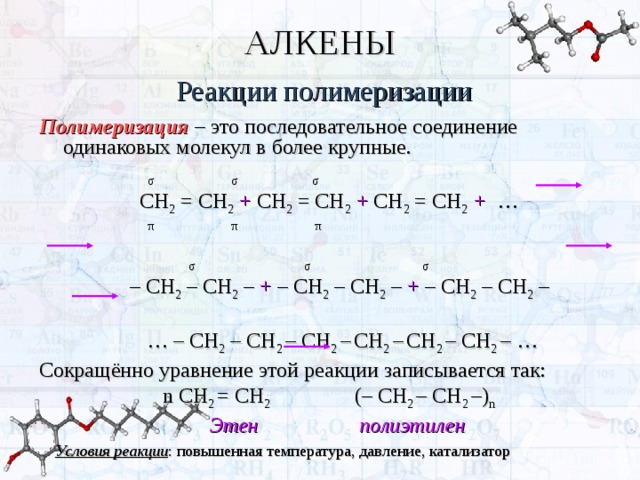
АЛКЕНЫ
Реакции полимеризации
Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
σ σ σ
СН 2 = СН 2 + СН 2 = СН 2 + СН 2 = СН 2 + …
π π π
σ σ σ
– СН 2 – СН 2 – + – СН 2 – СН 2 – + – СН 2 – СН 2 –
… – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 – …
Сокращённо уравнение этой реакции записывается так:
n СН 2 = СН 2 (– СН 2 – СН 2 –) n
Этен полиэтилен
Условия реакции : повышенная температура, давление, катализатор

АЛКЕНЫ
Реакции окисления
Реакция Вагнера (Мягкое окисление раствором перманганата калия)
3СН 2 = СН 2 + 2КМ n О 4 + 4Н 2 О
3СН 2 - СН 2 + 2М n О 2 + 2КОН
ОН ОН
Или
С 2 Н 4 + (О) + Н 2 О С 2 Н 4 (ОН) 2
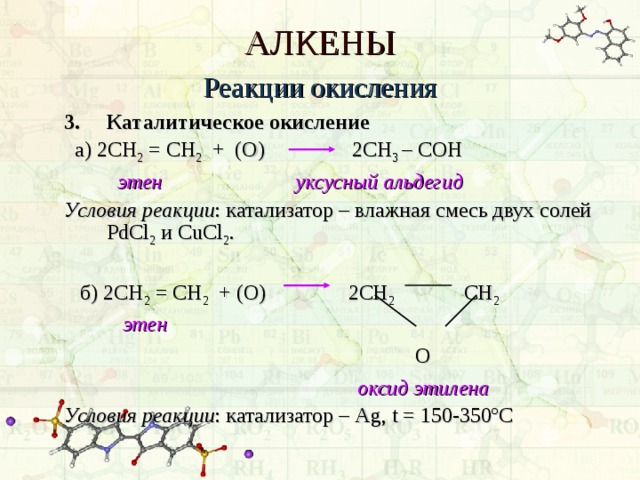
АЛКЕНЫ
Реакции окисления
3. Каталитическое окисление
а) 2СН 2 = СН 2 + (О) 2СН 3 – C ОН
этен уксусный альдегид
Условия реакции : катализатор – влажная смесь двух солей PdCl 2 и CuCl 2 .
б) 2СН 2 = СН 2 + (О) 2СН 2 СН 2
этен
О
оксид этилена
Условия реакции : катализатор – Ag , t = 150-350 º С

АЛКЕНЫ
Горение алкенов
Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая доля углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода.
С 4 Н 8 + 8О 2 4СО 2 + 4Н 2 О
бутен
При недостатке кислорода
С 4 Н 8 + 6О 2 4СО + 4Н 2 О
бутен

АЛКЕНЫ
Применение
Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов

 Получите свидетельство
Получите свидетельство Вход
Вход











 "Алкены. Этиленовые углеводороды" (3.42 MB)
"Алкены. Этиленовые углеводороды" (3.42 MB)
 0
0 2214
2214 34
34 Нравится
0
Нравится
0


