Видеоурок по химии «Понятие о спиртах»
Спирты — это органические вещества, в молекулах которых углеводородный радикал связан с гидроксильной группой — ОН.
Число гидроксильных групп — OH в молекуле определяет атомность спирта. Если в молекуле спирта 1 группа ОН, значит это одноатомный спирт, если 2 группы ОН, значит это двухатомный спирт, если 3 группы ОН, то это трёхатомный спирт. Общая формула спиртов СnH2n+1OH, или R-OH, где R — это углеводородный радикал.
Запомни, друг, и я и ты:
В них углерод и гидроксид,
И каждый спирт легко горит.
R — это значит: радикал,
Насыщенный иль непредельный.
Он может быть велик и мал,
Но это разговор отдельный…
Названия одноатомных спиртов образуются от названий соответствующих углеводородов с прибавлением суффикса — ол. Спирты, имеющие 1 — 11 атомов углерода находятся в жидком агрегатном состоянии, начиная с 12 атома углерода — это спирты, представляющие собой твёрдые вещества. Первые три представителя спиртов имеют алкогольный запах, они бесцветны и хорошо растворимы в воде. Среди спиртов отсутствуют газы из-за наличия водородных связей, кроме этого водородная связь обуславливает более высокие температуры кипения спиртов по сравнению с углеводородами с тем же числом атомов углерода.
Метанол, или метиловый спирт СН3ОН представляет собой бесцветную жидкость, Ткип. 64,7 0С. С водой смешивается в любых соотношениях, имеет своеобразный запах. Метанол чрезвычайно ядовит, опасны и его пары. Метанол является ядом нервно-паралитического действия, употребление небольшой дозы приводит к потере зрения и даже смерти человека.
Метиловый спирт впервые был получен при сухой перегонке древесины. По этой причине его ещё называют древесным спиртом. Формулу древесного спирта установил французский химик Ж. Б. Дюма в 1834 г. и только через 25 лет метиловый спирт был получен синтетическим путём.
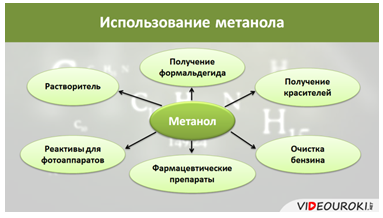
Его используют как растворитель, для получения формальдегида, красителей, реактивов для фотоаппаратов, получения фармацевтических препаратов, для очистки бензина.
Этанол, или этиловый спирт С2Н5ОН представляет собой бесцветную жидкость со слабым запахом и жгучим вкусом. Он легче воды и обладает характерным алкогольным запахом. Это летучая жидкость. Его температура кипения 78,3 0С. Смешивается с водой во всех соотношениях, является хорошим растворителем. Легко воспламеняется и горит слабо светящимся голубоватым пламенем.
Этиловый спирт — наркотик. При приёме внутрь он быстро всасывается в кровь, проникая в головной мозг, спирт действует на нервные клетки и вызывает опьянение. Под влиянием спиртного у человека ослабляет внимание, затормаживается реакция, изменяется поведение. Употребление спиртных напитков приводит к тяжёлому заболеванию — алкоголизму.
Химические свойства спиртов обусловлены наличием в них функциональных групп — ОН.
Таким образом, функциональная группа — это группа атомов, определяющая наиболее характерные свойства классов органических соединений.
Атом водорода при группе ОН очень подвижный, поэтому спирты проявляют слабые кислотные свойства. Поэтому спирты вступают в химические реакции с активными металлами. В результате взаимодействия этанола с натрием образуется соединение — этилат натрия и водород. Продукты замещения атома водорода гидроксильной группы на атом металла называют алкоголятами.
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Термин «алкоголи» предложил в 19 веке Я. Берцелиус, что в переводе с арабского означает «тонкий порошок», который образуется при выпаривании раствора.
Для спиртов характерны реакции окисления. Например, при окислении этанола образуется уксусный альдегид. Эту реакцию иллюстрирует следующий опыт. Накалим медную проволоку на пламени спиртовки. На проволоке образуется чёрный налёт. Затем опустим эту проволоку в пробирку с этиловым спиртом. Чёрный налёт растворяется и проволока опять приобретает прежний вид. Кроме этого, изменяется и запах, потому что этиловый спирт окислился до альдегида, имеющего специфический запах.
CH3 ― CH2OH + CuO CH3 ― COH + Cu↓ + H2O
При полном окислении этанола образуется углекислый газ и вода. Легко воспламеняется и горит слабо светящимся голубоватым пламенем.
С2Н5ОН + 3О2 → 2СО2↑ + 3Н2О
При взаимодействии с галогеноводородами образуются галогеналканы. Например, в реакции этанола с бромоводородом образуется бромэтан и вода.
C2H5OH + HBr ↔ C2H5Br + H2O
В промышленности этанол получают реакцией гидратации этилена.
H2SO4
H2C = CH2 + H2O → CH3 ― CH2OH
Таким методом получают технический этиловый спирт, который содержит примеси метилового спирта. Пищевой этиловый спирт получают ферментативным расщеплением сахаристых веществ. Ректификат — этиловый спирт, содержащий 4,5% воды, а абсолютный спирт — это безводный спирт. Денатурат — это этанол, содержащий цветные и дурнопахнущие вещества.
Этиловый спирт в громадных количествах используется для технических нужд. Его применяют как растворитель в лакокрасочной и химико-фармацевтической промышленности, для синтеза красителей и синтетического каучука, получения пластмасс, духов, при консервировании анатомических препаратов, для получения уксусной кислоты, антифризов, взрывчатых веществ, бытовой химии. Особенно большое значение этиловый спирт приобрел после того, как в 1930 году химик С.В. Лебедев открыл способ производства каучука из этанола. Этиловый спирт используют в медицине для компрессов, обтираний, дезинфекции кожи перед уколом. Его широко применяют для изготовления настоек и экстрактов, а также для лекарств. Этиловый спирт — основное сырьё ликёроводочных и винных производств. Для получения этилового спирта используют реакцию брожения сахаристых веществ.
При брожении глюкозы образуется этанол и углекислый газ.
C6H12O6 2С2Н5ОН + 2СО2↑
Рассмотрим многоатомные спирты: двухатомный спирт этиленгликоль и трёхатомный спирт — глицерин.
Этиленгликоль — СН2ОН ― СН2ОН — бесцветная густая жидкость, тяжелее воды. Кипит при температуре 197 0С, замерзает при температуре 13 0С. Он ядовит и имеет сладкий вкус. Не имеет запаха, смешивается с водой в любых соотношениях, гигроскопичен.
Этиленгликоль применяют в качестве антифризов, для получения лавсана, взрывчатых веществ.
Трёхатомный спирт — глицерин — СН2ОН ― СНОН ― СН2ОН, представляет собой сиропообразную бесцветную жидкость со сладким вкусом, температура кипения 290 0С, температура замерзания -17 0С. Глицерин хорошо растворим в воде, гигроскопичен.
Глицерин открыл знаменитый шведский химик Карл Шееле в 1779 г. Он нагревал оливковое масло с кислотой и получил мазь, которая оказалась сладкой на вкус. Из мази Шееле выделил вязкую жидкость, которую назвал масляный сахар. Это и был глицерин.
Глицерин применяется в кожевенной промышленности, парфюмерии, медицине, водные растворы глицерина используют в качестве антифризов, для производства взрывчатых веществ, в текстильной и пищевой промышленности, в фармацевтической и косметической промышленности.
Качественной реакцией на многоатомные спирты является реакция со свежеприготовленным гидроксидом меди (II). Сначала нужно получить гидроксид меди (II). Для этого к раствору гидроксида натрия нужно прилить раствор медного купороса, в результате у на образуется осадок голубого цвета. После этого, к этому осадку добавим глицерин, осадок растворяется и раствор приобретает ярко-синий цвет.
Таким образом, спирты содержат функциональную группу — ОН, метанол и этанол — представители насыщенных одноатомных спиртов. Характерные свойства спиртов определяются наличием в их молекулах функциональной группы — ОН. Этанол и метанол широко используются во многих отраслях промышленности. Представителями многоатомных спиртов являются этиленгликоль и глицерин. Качественной реакцией на многоатомные спирты является реакция с гидроксидом меди (II). Этиленгликоль и глицерин используют также во многих отраслях производства.
Получите комплекты видеоуроков + онлайн версии
Похожие записи
 27145
27145 Нравится
0
Нравится
0
Комментарии 13
Чтобы добавить комментарий зарегистрируйтесь или войдите на сайт
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0

 Получите свидетельство
Получите свидетельство Вход
Вход









