Общая характеристика халькогенов. Кислород
Цель: изучить особенности строения атомов халькогенов, свойства и применение кислорода.
Задачи:
- сформировать представления об особенностях строение элементов VIA группы;
- развитие умений записывать уравнения реакций, отражающих химические свойства кислорода;
- изучить способы получения кислорода, его аллотропные модификации;
1. Организационный момент.
2. Изучение нового материала.
Халькогены — это элементы VIA группы. Родоначальником этой группы является кислород. Кроме кислорода в эту группу входят S, Se, Te, Po. Название халькогены означает «рождающие руды». Вам уже известны руды, содержащие серу, это — пирит, или железный колчедан — FeS2, киноварь — HgS, цинковая обманка — ZnS. Кислород входит в состав таких руд, как корунд — Al2O3, магнитный железняк, или магнетит — Fe3O4, красный железняк, или гематит — Fe2O3, бурый железняк, или лимонит — 2Fe2O3 · 3H2O, а также в состав других руд.
На внешнем энергетическом уровне у халькогенов 6 электронов. До завершения внешнего энергетического уровня атомам не хватает 2 электрона, поэтому они присоединяют электроны и проявляют в своих соединениях степень окисления -2. Кислород в соединении с фтором — OF2 проявляет степень окисления +2. Атомы серы, селена и теллура в своих соединениях с более электроотрицательными элементами проявляют положительные степени окисления +2, +4 и +6.
Кислород — самый распространенный элемент на Земле. Он входит в состав воды, которая покрывает поверхность земного шара, образуя его водную оболочку — гидросферу. Кислород входит в состав атмосферы, где на его долю приходится 21%. Кроме этого, он ещё входит в состав многих органических соединений.
Существует несколько способов получения кислорода. В промышленности кислород получают из жидкого воздуха.
Еще в 1774 г. Дж. Пристли, используя стеклянную двояковыпуклую линзу, направил сконцентрированный ею пучок солнечных лучей на оксид ртути (II) и получил кислород.
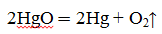
Одновременно с Пристли кислород получил К. Шееле путём нагревания селитры.
Название кислороду — oxygenium,
Кислород можно получить и при разложении воды в специальном устройстве — электролизёре. Таким образом, можно получить сразу два газа: кислород и водород.
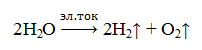
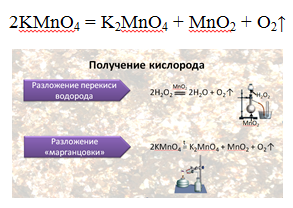
В лаборатории для получения кислорода используют пероксид водорода (Н2О2). Эта реакция идёт в присутствии катализатора — оксида марганца IV.
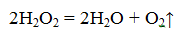
Для получения кислорода в лаборатории ещё используют реакцию разложения перманганата калия — KMnO4 — «марганцовки».
Вы уже знаете, что кислород существует в виде двух аллотропных модификаций -O2 и О3. Аллотропия кислорода и озона обусловлена различным числом кислорода в молекулах веществ.
|
Вещество |
Агрегатное состояние при обычных условиях |
Цвет |
Запах |
Температура плавления, 0С |
Температура кипения, 0С |
|
Кислород О2 |
Газ |
Бесцветный, в жидком состоянии — голубой |
Без запаха |
— 218,2 |
— 182,8 |
|
Озон О3 |
Газ |
Бесцветный, в жидком состоянии — синий |
Резкий, характерный запах |
— 251 |
— 112 |
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платины.
Кислород энергично реагирует с металлами. Например, в реакции с литием, образуется оксид лития, в реакции с медью — оксид меди (II).
4Li + O2 = 2Li2O
2Cu + O2 = 2CuO
Кислород реагирует с неметаллами. Так в реакции с cерой образуется оксид серы (IV), в реакции с фосфором — оксид фосфора (V).
S + O2 = SO2
4P + 5O2 = 2P2O5
Почти все реакции с кислородом экзотермические (то есть сопровождаются выделением теплоты). Исключение составляет реакция азота с кислородом, которая является эндотермической.
N2 + O2 ↔ 2NO — Q
Кислород окисляет не только простые, но и сложные вещества. Например, в реакции горения метана образуется вода и углекислый газ, в результате горения сероводорода образуется сернистый газ и вода.
CH4 + 2O2 = CO2↑ + 2H2O
2H2S + 3O2 = 2SO2↑ + 2H2O
Эта окислительная способность кислорода лежит в основе горения всех видов топлива. Кислород в этих реакциях выступает в роли окислителя.
Кислород участвует в процессах дыхания, медленного окисления различных веществ при обычной температуре. Например, медленное окисление пищи в нашем организме является источником энергии, за счёт которой живет организм. Так гемоглобин, соединенный с кислородом, оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы, образуя при этом углекислый газ и воду и освобождая при этом энергию, необходимую для деятельности организма.
Велика роль кислорода в процессах дыхания человека и животных. У растений в процессе фотосинтеза из углекислого газа и воды образуется глюкоза и кислород. За счет этого процесса сохраняется содержание свободного кислорода.
В природе постоянно осуществляется круговорот кислорода.
Проведём эксперимент: нальём два стаканчика перекиси водорода. В первый стаканчик добавим оксида марганца (IV), у нас наблюдается бурное выделение кислорода. Оксид марганца (IV) в данном случае катализатор, он ускоряет процесс разложения перекиси водорода. Если поднести к стаканчику тлеющую лучинку, то она вспыхнет из-за скопившегося кислорода.
В другой стаканчик добавим натёртую морковь, здесь тоже происходит бурное выделение кислорода, и если поднести тлеющую лучинку, то она вспыхнет. В данном случае фермент каталаза, который содержится в моркови, тоже способствует разложению перекиси водорода.
Кислород применяется в металлургической и химической промышленности для ускорения производственных процессов. Чистый кислород применяют при газовой сварке и резке металлов. Его используют и для жизнеобеспечения на подводных и космических кораблях, при работе водолазов и пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания и различных заболеваниях. Кислород применяют в космической технике, как окислитель ракетного топлива, в производстве взрывчатых смесей.
Кислорол хранят в стальных баллонах, окрашенных в голубой цвет, под высоким давлением, а в лаборатории — в специальных приборах — газометрах.
Таким образом, халькогены — это элементы VIA группы. На внешнем энергетическом уровне у них 6 электронов. Они входят в состав многих руд. Кислород первый представитель группы. В реакциях он проявляет окислительные свойства. Кислород получают реакцией разложения перекиси водорода, марганцовки, воды, а в промышленности — из воздуха. Кислород участвует в круговороте веществ и применяется в химической и металлургической промышленности.
3. Закрепление.
1. С какими веществами вы познакомились сегодня на уроке?
2. Какие физические свойства характерны для кислорода?
3. Как получают кислород в промышленности?
4. Как получают кислород в лаборатории?
5. Что такое катализаторы, для чего их применяют?
6. Как осуществляется круговорот кислорода в природе?
7. Где применяют кислород?
4. Рефлексия.
«Плюс-минус»: таблица состоит из трёх граф, в графу «П» — «плюс» записывается всё, что понравилось на уроке, в графу «М» — «минус», что не понравилось.
5. Домашнее задание.
Получите комплекты видеоуроков + онлайн версии
Похожие записи
 42423
42423 Нравится
0
Нравится
0
Комментарии 10
Чтобы добавить комментарий зарегистрируйтесь или войдите на сайт
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0
 Нравится
0
Нравится
0

 Получите свидетельство
Получите свидетельство Вход
Вход









