Конспект урока по химии 10 класс «Применение метода полуреакций в органической химии».
Крецу Лариса Васильевна, учитель химии и биологии, стаж работы 15 лет, МБОУ «Лицей №174» г. Зеленогорск, первая категория, [email protected], 89082005030.
Тема «Применение метода полуреакций в органической химии».
Класс 10.
Учебник Габриелян О.С, Химия. 10 класс Углубленный уровень : /О.С. Габриелян, И. Г. Остроумов. – 2-е изд., стереотип. – М. : Дрофа, 2014. – 366, [2] с. :ил.
Аннатация.
В курсе химии понятие «окислительно-восстановительные реакции (ОВР)»формируется в несколько этапов. Первое понятие окисления дается в 8 классе, понятие о восстановлении трактуется как разновидность реакций замещения и как процесс отнятия кислорода от вещества. Затем после изучения темы «Периодический закон. Химическая связь формирование понятия ОВР идет на более высоком уровне на основе электронной теории.
После изучения специфических свойств серной кислоты я провожу занятие, посвященное двум методам составления ОВР, где знакомлю школьников с ионно-электронным методом. Эти знания закрепляю в теме «Подгруппа азота» при изучении взаимодействия азотной кислоты разной концентрации с различными металлами.
При изучении всего последующего материала ученики, хорошо овладевшие методом полуреакций, пользуются им постоянно как более легким и интересным.
При решении олимпиадных задач и вопросов ЕГЭ этот метод помогает определить и найти все продукты реакции и затем делать расчеты.
Цель урока: Показать применение метода полуреакций при составлении окислительно-восстановительных реакций в органической химии; дать алгоритм составления таких уравнений.
Оборудование:
Окислители, восстановители – таблица;
Таблица составления полуреакций – (на каждый стол);
Таблица-алгоритм - (на каждый стол);
Схемы KMnO4 в разных средах.
Ход урока
Учитель. Тема нашего занятия – применение метода полуреакций в органической химии. При составлении ОВР всегда учитывается закон сохранения массы и энергии: сохраняется число атомов и число электрических зарядов в исходных веществах и продуктах реакции.
При составлении ОВР вы знаите два метода. Какие?
Ученик. Метод электронного баланса и ионно-электронный или метод полуреакций.
Учитель. Дадим краткую характеристику каждого метода.
Ученик. В методе электронного баланса используются степени окисления.
Метод ионно-электронный основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
Учитель. Методом электронного баланса вы пользуетесь постоянно, а методом полуреакций овладели не все, но те, кто его знает, отдают ему предпочтение.
Мы знакомились с данным методом в 9 классе и составляли такие уравнения по неорганической химии. Сегодня посмотрим, как используется этот метод в органической химии.
Основная часть.
Решение задач для сравнения методов.
Укажите, какой элемент окисляется в реакции между этиленом и нейтральным водным раствором перманганата калия: углерод, водород, марганец, кислород.
Записываем схему, используя приложения 1 и 2:
СН2=СН2 + KMnO4 + H2O → CH2OH- CH2OH + MnO2 + ?
С2-2Н4+1 С2-1Н6+1О2-2
3 2С-2 – 2е →2С-1 (окисление)
2 Mn+7 + 3е → Mn+4 (восстановление)
Окисляется углерод (на вопрос ответили, но уравнение не закончено).
Попробуем решить ионно-электронным методом.
3 С2Н4 + 2Н2О – 2е → С2Н6О2 + 2Н1+ (окисление)
2 (MnO4)1- + 2Н2О + 3е → MnO2 + 4ОН1- (восстановление)
3С2Н4 + 6Н2О + 2(MnO4)1- + 4Н2О → 3С2Н6О2 +6Н1+ + 2MnO2 + 8ОН1-
3С2Н4 + 2(MnO4)1- + 4Н2О → 3С2Н6О2 + 2MnO2 + 2ОН1-
2K1+ 2K1+
3 + СН2=СН2 + 2KMnO4 + 4Н2О → 3CH2OH- CH2OH + 2MnO2 + 2KОН
Исходя из данного решения, сравнивая метод электронного баланса и ионно-электронный, делаем выводы, что важнейшими достоинствами ионно-электронного метода являются:
Рассматриваются реально существующие ионы: (MnO4)1-; Mn2+; (MnO4)2-; (SO4)2-; (SO3)2-; (Cr2O7)2- и вещества С2Н4; С2Н6О2 и другие.
Не нужно знать все получившиеся вещества, они появляются в уравнении реакции при его выводе.
Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется значительно реже, чем в неорганической.
В тех случаях, когда реакция сопровождается переносом атомов кислорода, не изменяющих своей степени окисления, недостающие атомы кислорода добавляют в кислой и нейтральной средах в виде молекул воды, а в щелочной среде в виде гидроксид ионов. Напротив, лишние атомы кислорода в кислой среде связывают протонами, в щелочной и нейтральной – молекулами воды (объяснение по схеме на плакате и такая же схема на каждом ученическом столе – приложение 3).
Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальванических элементах и при электролизе (по схемам краткая характеристика процессов).
Применение знаний в аналогичной ситуации и выполнение упражнений по алгоритму (приложение 4)
Задания
Составить уравнение реакции окисления ацетилена раствором перманганата калия до щавелевой кислоты СООН-СООН (среда нейтральная).
Составить уравнение реакции окисления толуола перманганатом калия в кислой среде бензойной кислоты С6Н5СООН.
При окислении формиата натрия НСООNa перманганатом калия в щелочной среде (NaОН) образуется карбонат калия, а степень окисления марганца изменяется до +6.
Составить уравнения реакций ионно-электонным методом.
(Самостоятельная работа в тетрадях с проверкой (двое работают одновременно у закрытой доски), ответ на третью задачу записан на внутренней доске. Выполнявшие работу у доски дают консультации тем, у кого есть вопросы).
Третье задание объясняет тот, у кого оно выполнено без ошибок.
НСООNa + KMnO4 + NaОН → K2CO3 + (MnO4)2-
1 НСОО1- + 3ОН1- - 2е → (СО3)2- + 2Н2О (окисление)
2 (MnO4)1- + 1е → (MnO4)2- (восстановление)
НСОО1- + 3ОН1- + 2(MnO4)1- → (СО3)2- + 2Н2О + (MnO4)2-
Na1+ 3Na1+ 2К1+ 2К1+ 4Na1+
НСООNa + 3NaОН + 2KMnO4 → К2СО3 + 2Na2MnO4 + 2Н2О
Кто работает быстро, взял дополнительную карточку (приложение 5).
Использование знаний в нестандартных условиях
Творческие задания – решение расчетных задач с использованием метода полуреакций.
Задания (по выбору)
Задания 1-го уровня
1 вариант
С2Н5ОН + KMnO4 + Н2SO4 → СН3СООН + Mn2+
Сколько перманганата калия нужно для окисления 4,6г этанола?
2 вариант
СН3ОН + KMnO4 + Н2SO4 → НСООН + Mn2+
Сколько перманганата калия нужно для окисления 6,4г метанола?
Задания 2-го уровня
1 вариант
Сколько граммов дихромата калия и серной кислоты потребуется для окисления 35г пропилового спирта?
(Cr+6 → Cr+3)
2 вариант
Сколько граммов дихромата калия и серной кислоты потребуется для окисления 940г фенола до хинона – С6Н4О2?
Задания 3-го уровня
Работа в четверках (даны карточки-задания и карточки-информаторы; к решению можно обратиться при проверке и при затруднении).
Задача №1.
1,4г смеси метилового и этилового спиртов окислили раствором перманганата калия, подкисленным Н2SO4.
Выделившийся газ пропустили в избыток баритовой воды, при этом выделилось 1,97г осадка. Определить процентный состав смеси.
Задача №2.
68г смеси бензола, толуола и этилбензола окислили подкисленным раствором перманганата калия. При этом образовалось 36,6г бензойной кислоты и выделилось 2,25г углекислого газа. Определить процентный состав смеси.
Задача №3.
При взаимодействии концентрированной серной кислоты с сахарной пудрой С12Н22О11 получили 16,8л смеси газов (СО2 и SО2) и воду. При пропускании образовавшейся смеси газов через раствор перманганата калия получили сульфат калия, оксид марганца(IV) и серную кислоту. Определить объемный состав полученной газовой смеси (растворимостью газов пренебречь). Рассчитать количество израсходованной соли - перманганата калия.
Задача №4.
Смесь этилового и метилового спиртов окислили подкисленным раствором перманганата калия. Выделившийся газ пропустили в избыток баритовой воды, при этом выделилось 1,97г осадка. Такое же количество той же смеси сожгли в избытке кислорода При пропускании образовавшегося газа в избыток баритовой воды получили 5,96г осадка.
Определить молярный состав исходной смеси.
Решив свою задачу, ребята обмениваются карточками, решают следующую задачу, консультируясь, если надо. (Решившие задачи первого задания берут карточку второго задания и тд.).
В конце двух уроков даю домашнее задание: для желающих – дифференцированное (карточки по уровням А, В, С).
Ставлю оценки по результатам последнего этапа самостоятельной работы.
Приложения
Приложение 1.
Важнейшие восстановители и окислители
| восстановители | окислители |
| Металлы,Н2, уголь, СО, Н2S, SO2, Н2SO3 и ее соли HI, HBr, HCl SnCl2, FeSO4, MnSO4, Cr(SO4)3 НNO2, NН3, NO Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе | Галогены KMnO4, K2MnO4, MnO2,К2Cr2O7, К2Cr2O4 НNO3, Н2О2, О3, О2 Н2SO4(конц), Н2SеO4, CuO, AgO, PbO2, FeCl3 Ионы благородных металлов (Ag1+, Au3+ ) Гипохлориты, хлораты, перхлораты, «Царская водка» Анод при электролизе |
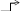 Mn2+ бесцветный раствор
Mn2+ бесцветный раствор
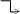
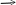 (MnO4)1- MnO2 бурый осадок
(MnO4)1- MnO2 бурый осадок
(MnO4)2- зеленый раствор
Приложение 2.
Карточка-задание
|
№ 9 Са + НNO3 → соль + N2O↑ + вода (20%-ый р-р)
|
Карточка-ответ
| № 9 Са + НNO3 → Са(NO3)2 + N2O↑ + Н2О (20%-ый р-р) 4 8 Са0 – 2е → Са2+ (окисление) 1 2 2(NO3)1- + 10Н1+ + 8е → N2O + 5Н2О (восстановление)
4Са + 2(NO3)1- + 10Н1+ → 4Са2+ + N2O + 5Н2О 8(NO3)1- 8(NO3)1-
4Са + 10НNO3 = 4Са(NO3)2 + N2O↑ + 5Н2О
|
Приложение 3.
Баланс кислорода
| Среда реакции | Избыток атомов кислорода (n) | Недостаток атомов кислорода (n) |
|
Кислая Нейтральная Щелочная |
…+ 2nН1+→nН2О + … …+ nН2О → 2nОН1- + … …+ nН2О → 2nОН1- + … |
…+ nН2О → 2nН1+ + … …+ nН2О → 2nН1+ + … …+ 2nОН1- → nН2О+ …
|
«Избыток» атомов кислорода в левой части уравнения связывается либо в воду (кислая среда), либо в гидроксигруппы (нейтральная и щелочная).
«Недостаток» же атомов кислорода, напротив, возмещается из воды (кислая и нейтральная среды) и из удвоенного числа гидроксигрупп (щелочная среда).
Приложение 4.
Алгоритм составления ОВР
ионно-электронным методом (методом полуреакций)
Запишите в левой части уравнения формулы исходных веществ. Для создания в растворах кислой среды обычно пользуются серной кислотой. Хлороводородная и азотная кислоты применяются редко, так как первая способна окисляться, а вторая сама – сильный окислитель.
Определите окислитель и восстановитель.
Составьте схемы ионно-электронных уравнений полуреакций для процессов окисления и восстановления; в схему включаются те реальные частицы, которые проявляют окислительные и восстановительные свойства, а также частицы, характеризующие среду (кислую - Н1+, щелочную - ОН1-, нейтральную - Н2О). Сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные вещества, труднорастворимые соединения – в виде молекул.
Проверьте число атомов кислорода в каждом уравнении полуреакции слева и справа и уравняйте их.
Проверьте число атомов каждого элемента в левой и правой частях схем уравнений полуреакций окисления и восстановления. При необходимости уравняйте их.
Проверьте равенство сумм зарядов до и после реакции, в соответвтвии с законом электронейтральности - суммарное число зарядов продуктов реакции должно быть равно суммарному числу зарядов исходных веществ.
Согласно закону сохранения энергии (материи), общее число электронов, отдаваемых восстановителем, должно быть равно общему числу электронов, присоединенных окислителем. Исходя из этого, подберите коэффициенты для окислителя и восстановителя.
Суммируйте подобные члены, если таковые имеются.
Перепишите ионно-молекулярное (ионное) уравнение.
Чтобы по ионному уравнению составить молекулярное, необходимо в левой и правой частях уравнения каждому аниону приписать соответствующее число катионов, а каждому катиону – число анионов. Скомпонуйте ионы в молекулы.
Приложение 5.
Карточка-задание
|
Задача. При окислении гексена-2 (цис- или трансизомера) в нейтральной среде образуются гександиол-2,3 и диоксид марганца. Составить уравнение реакции ионно-электронным методом.
|
Карточка-ответ
| СН3-СН=СН-СН2-СН2-СН3 + KMnO4 + Н2О → СН3-СНОН-СНОН-СН2-СН2-СН3 + MnO2 3 С6Н12 + 2Н2О – 2е → С6Н12(ОН)2 + 2Н1+ (окисление) 2 (MnO4)1- + 2Н2О + 3е → MnO2 +4ОН1- (восстановление)
3С6Н12 + 6Н2О + 2(MnO4)1- + 4Н2О → 3С6Н12(ОН)2 + 6Н1+ + 2MnO2 + 8ОН1- 3С6Н12 + 4Н2О + 2(MnO4)1- → 3С6Н12(ОН)2 + 2MnO2 + 2ОН1- 2К+ 2К+
3С6Н12 + 2КMnO4 + 4Н2О → 3С6Н12(ОН)2 + 2MnO2 + 2КОН |
Приложение 6.
Карточка-информатор
| Задача № 3. При взаимодействии Н2SO4(конц) с сахарной пудрой… Ответ Серная кислота обладает сильным водоотнимающим свойством: Н2SO4(конц)  С12Н22О11 12С +11Н2О (1) При этом Н2SO4 взаимодействует с образовавшимся углем:
С + 2Н2SO4 → СО2↑ + 2SO2↑ + 2Н2О (2) При пропускании смеси газов через раствор КMnO4 во взаимодействие вступит SO2 как восстановитель: SO2 + КMnO4 + Н2О → (SO4)2- + MnO2 3 SO2 + 2Н2О -2е → (SO4)2- + 4Н1+ (окисление) 2 (MnO4)1- + 2Н2О + 3е → MnO2 + 4ОН1- (восстановление)
3SO2 + 6Н2О + 2(MnO4)1-+ 4Н2О → 3(SO4)2- + 12Н1+ + 2MnO2 + 8ОН1- 3SO2 + + 2(MnO4)1- + 2Н2О → 3(SO4)2- + 4Н1+ + 2MnO2 2К+ 2К+
3SO2 + + 2КMnO4+ 2Н2О → К2SO4 + 2Н2SO4+ 2MnO2 (3)
Из уравнения (2) соотношение объемов газов: СО2 - 2SO2 1 : 2 16,8л – 3 части 1 часть СО2 составляет 5,6л СО2 2 части SO2 11,2л SO2 Из уравнения (3): 11,2л хг 3SO2 2КMnO4 67,2л 158г 11,2(л)/67,2(л) = х(г)/158(г); Х = 11,2(л) * 158(г)/67,2(л) = 26,3 г Ответ: V (СО2) = 5,6л, V (SО2) = 11,2л, m(КMnO4) = 26,3г |

 Получите свидетельство
Получите свидетельство Вход
Вход












 Конспект урока химии 10 класс (52.83 KB)
Конспект урока химии 10 класс (52.83 KB)
 0
0 43
43 0
0 Нравится
0
Нравится
0


