Тема урока: ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, ЕЕ СУЩНОСТЬ.
Цель урока: познакомить с понятием «электролит», «неэлектролит», «электролитическая диссоциация», «гидратация», «кристаллогидраты» и их применение.
Ход урока.
I. Организационный момент.
II. Проверка домашнего задания:
- фронтальный опрос по теме «Обратимые и необратимые реакции. Химическое равновесие»( к & 5)
Вопросы:
1.Какие реакции называют обратимыми ? необратимыми? ( примеры реакций)
2.Что такое хим. равновесие? Какому правилу оно подчиняется?
3.Влияние условий на хим. равновесие ( принцип Ле Шателье )
4.Проверка домашнего задания ( стр.18.№3,стр.19 №1)
-
III. Изучение нового материала
Лекция по плану:
-Показ видеофильма по теме «Испытание веществ на электропроводимость. Электролитическая диссоциация»:
- Молекулы воды, как электрический диполь.
- Механизм растворения в воде веществ с ионной связью.
- Тепловые явления при растворении.
- Электролиты. Электролитическая диссоциация, как обратимый процесс.
- Основные положения ТЭД.
- Кристаллогидраты ( примеры веществ) ,их применение.
Учитель. В 1887г. шведский учёный Сванте Август Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации. В дальнейшем эта теория была развита многими учёными, в том числе И.А. Каблуковым и В.А. Кистяковским.
Перед нами будет проблема: Выяснить, что такое ЭЛД, ее положения?
А сейчас просмотрим видеофильм по теме «ЭЛД» (просмотр видеофильма)
Учитель. Просмотрев видеофильм, давайте с вами подведем итог и сделаем выводы, ответив на вопросы:
1.Какие вещества проводят электрический ток, а какие не проводят? ( примеры веществ по просмотренному видеофильму).
2.В чем причина электропроводности у одних веществ и отсутствие ее у других? (электрический ток проводят те вещества, которые распадаются на ионы)
3.Что такое электролиты и неэлектролиты?
Задание: Запишите в тетради в две колонки ,озаглавив колонки «электролиты» и «неэлектролиты» формулы тех веществ, которые проводят эл. ток и не проводят.
Растворы всех веществ можно разделить на две группы: электролиты – это вещества водные растворы или расплавы которых проводят электрический ток, неэлектролиты - не проводят электрический ток.
К неэлектролитам относится большая часть органических соединений, например глюкоза, сахароза,бензол, сухие соли и основания, газы
К электролитам относятся растворы кислот, солей, щелочей.
В растворе или расплаве электролиты распадаются на ионы, т.е. диссоциируют. Распад электролитов на ионы при растворении их в воде наз. электролитической диссоциацией. Одновременно с распадом электролита на ионы происходит объединение ионов в молекулы.
Механизм электролитической диссоциации
NaCl – ионное соединение, в узлах его кристаллической решетки находятся ионы Na+ и Cl--. Молекула воды является диполем ( атом кислорода им. отрицательный заряд, атом водорода – положительный). При распаде кристаллов соли (диссоциация) молекулы воды притягиваются своими отрицательными полюсами к Na+ , а положительными полюсами к Cl--. В раствор переходят ионы натрия и хлора, окруженные молекулами воды, наз. гидратированные ионы, а процесс наз. гидратация. Гидратированные ионы могут иметь разную окраску ( ионы Cu2+ голубую). При выпаривании раствора CuSO4 образуются кристаллы голубого цвета. Вещества,содержащие в своем составе связанную воду наз. кристаллогидраты. Присоединение воды к ионам (гидратация) сопровождается ,как выделением энергии( растворение в воде конц.H2SO4) так и поглощением энергии ( растворение в воде аммиачной селитры)
Задание: Впишите в тетради формулы кристаллогидратов и их название (стр. 25)
Учитель. Сейчас разберем вопрос «Основные положения теории ЭЛД».
Современное содержание ТЭД можно свести к четырем основным положениям:
I-е положение: Все вещества по их способности проводить электрический ток в
растворах делятся на электролиты и неэлектролиты.
В
 ещества в растворах
ещества в растворах
Электролиты Неэлектролиты
(водные растворы проводят эл.ток) (водные растворы не проводят эл. ток)


Вещества с ионной и Вещества с ковалентной неполярной ковалентной полярной связью и слабополярной связью


Все растворимые кислоты, Все простые вещества, все оксиды и
основания (щёлочи) и соли н/р кислоты, основания и соли.
II-е положение ТЭД: В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы.
Процесс распада электролита на ионы называется электролитической диссоциацией (ЭД). Причиной диссоциации электролита является его взаимодействие с молекулами воды (гидратация).
Типы ионов
По заряду: катионы (положительные) и анионы (отрицательные);
По отношению к воде: Гидратированные и негидратированные ( в безводных средах)
По составу: простые и сложные.
1. Последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей):
1) ориентация молекул — диполей воды около ионов кристалла;
2) гидратация (взаимодействие с молекулами воды) ионов поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированн
Схема электролитической диссоциации ( + таблица на доске)
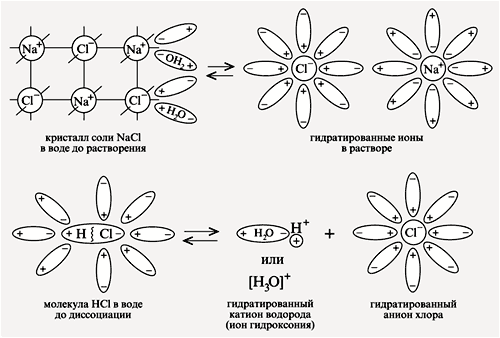
Последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей ,щелочей):
1) ориентация молекул — диполей воды около ионов кристалла;
2) гидратация (взаимодействие с молекулами воды) ионов поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как жидкий аммиак и жидкий диоксид серы.
Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко.
Одновременно с распадом электролита на ионы происходит объединение ионов в молекулы. Поэтому ЭЛД является обратимым процессом и при написании уравнений диссоциации указывается,что реакция идет в обе стороны:
Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации:
NaCl = Na+ + Cl-
HCl = H+ + Cl-
III-е положение ТЭД: Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду.
IV-е положение ТЭД: Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
![]()
IV. Закрепление изученного.
Вопросы:
1. Назовите «Основные положения ЭЛД»
2.Что такое электролиты,неэлектролиты, гидратированные ионы, ЭЛД?
3.Что такое гидратация, диссоциация? (гидратация – это взаимодействие молекул воды с ионами поверхностного слоя кристаллов, диссоциация – это распад кристалла электролита на гидратированные ионы)
4.Назовите устно формулы электролитов в водных растворах которых им.ионы:
а) Na+ S2- ; б) K+OH- ; в) H+Cl-
V.Дом.задание. &6. Тесты на стр.29 ( № 1-3)
7

 Получите свидетельство
Получите свидетельство Вход
Вход












 Электролиты. Неэлектролиты. ЭЛД,ее сущность. (76.5 KB)
Электролиты. Неэлектролиты. ЭЛД,ее сущность. (76.5 KB)
 0
0 1584
1584 91
91 Нравится
0
Нравится
0


