На одном из прошлых уроков мы с вами говорили о том, что все тела состоят из мельчайших частиц — атомов и молекул. Такое предположение было высказано ещё древнегреческим философом Демокритом почти две с половиной тысячи лет назад. Напомним, что Демокрит предполагал, что если делить вещество на всё более мелкие части, то в конце концов должна остаться одна частица, которая сохранит свойства данного вещества, но поделить её уже невозможно. Эту самую маленькую частицу философ назвал атомом, что в переводе с греческого означает «неделимый».
Однако случайное открытие Анри Беккерелем естественной радиоактивности в конце XIX века подставило под сомнение представления Демокрита.
В это время уже было известно такое явление, как фосфоресценция, то есть свечение некоторых веществ, возникающее после их облучения солнечными лучами. Так вот, экспериментируя с солями урана, Беккерель заворачивал фотопластинку в плотную чёрную бумагу и клал на неё сверху несколько кусочков урановой соли. Затем это всё выставлялось на солнечный свет. После проявления фотопластинки на ней обнаруживались тёмные пятна в тех местах, где лежали крупинки соли. Беккерель, как и все, полагал, что это излучение возникает под действием солнечных лучей. Но в феврале 1896 года, провести очередной опыт не удалось из-за плохой погоды. Учёный убрал пластинку в ящик стола, положив на неё сверху медный крест, который был покрыт солями урана.

Спустя пару дней Беккерель почему-то решил проявить фотопластинку. К его большому удивлению, на пластинке отчётливо виднелась тень в форме креста. 23 марта 1896 года Беккерель продемонстрировал результаты опытов на заседании Парижской академии наук, предположив, что обнаружил разновидность фосфоресценции, но не обычной, а «невидимой и долгосрочной».
В том же году Беккерель убедился, что открытое им излучение не является фосфоресценцией, так как оно, подобно рентгеновским лучам, ионизирует воздух и разряжает электроскоп. При этом он показал, что интенсивность самопроизвольного излучения определяется только количеством урана в препарате и совершенно не зависит от того, в какие соединения он входит. Отсюда следовало, что это свойство присуще не соединениям, а атомам урана.
Исследования Беккереля стали фундаментом для работ других французских учёных — супругов Пьера и Марии Кюри. Систематическое исследование руд, содержащих уран, с помощью пьезоэлектри́ческих весов, квадрантного электрометра и ионизационной камеры, подсоединённой к батарее, позволило Марии Склодовской-Кюри к началу 1898 года открыть радиоактивность ряда веществ, в том числе тория. А уже 13 июня того же года супруги Кюри смогли выделить новый, ранее неизвестный химический элемент — полоний, названный так в честь родины Марии Кюри — Польши.

В середине ноября супруги Кюри вернулись к своим опытам и буквально через месяц смогли выделить новый химический, который был в 2—3 миллиона раз активнее урана. 20 декабря новый элемент в лабораторной книге Кюри получил название «радий», что по латыни означает «лучистый».
Радий обладал уникальными свойствами: самопроизвольно разогревался, светился в темноте. У учёных оказался важнейший исследовательский инструмент в руках. Была проведена серия экспериментов с препаратами радия. В ходе них стало понятно, что радиоактивность — это способность атомов некоторых химических элементов к самопроизвольному излучению. Такую радиоактивность ещё называют естественной радиоактивностью. Так был положен конец представлениям, которые бытовали в химии на протяжении двух тысячелетий, о неизменности химических элементов.
После открытия радиоактивных элементов началось исследование физической природы их излучения. В 1899 году уроженец Новой Зеландии Эрнест Резерфорд поставил классический опыт, позволивший обнаружить сложный состав радиоактивного излучения. Установка состояла из толстостенного свинцового ящика внутрь которого помещались крупицы урановой соли. Из ящика сквозь узкое отверстие выходил направленный и сфокусированный пучок радиоактивного излучения, который попадал на фотопластинку. После проявления фотопластинки на ней обнаруживалось тёмное пятно в том месте, куда попадал пучок.
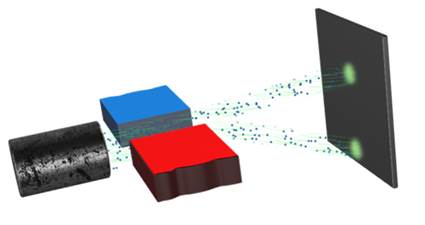
Однако оказалось, что если пропустить излучение урана через магнитное поле, то излучение разделяется на два компонента, которые позже были названы альфа- и бета-лучами согласно первым буквам греческого алфавита.
Вскоре опыты показали, что не только при альфа-излучении, но и при бета-распаде происходит превращение одного химического элемента в другой. Однако механизм обоих превращений не был понятен вплоть до 1911 года. Лишь после того, как Резерфордом была предложена ядерная модель атома, стало понятно, что именно ядро претерпевает изменения при радиоактивных превращениях.
В тысяча 1900 году Беккерель первым измерил (приблизительно) отношения заряда к массе бета-частиц и установил, что оно такого же порядка, как и для частиц катодных лучей. Проще говоря, бета-лучи являются потоком электронов, движущихся со скоростями, близкими к скорости света.
Посмотрите, как записывается реакция бета-распада ядра атома:

Число, которое стоит вверху перед буквенным обозначением ядра, называется массовым числом, а внизу — зарядовым числом (или атомным номером).
Массовое число ядра атома обозначается большой буквой А. Оно с точностью до целых чисел равно числу атомных единиц массы, содержащихся в массе ядра данного химического элемента.
Одна атомная единица массы — это внесистемная единица массы, которая применяется для масс молекул, атомов, атомных ядер и элементарных частиц. Она определяется как одна двенадцатая часть массы свободного покоящегося атома углерода:

Зарядовое число ядра атома обозначается большой латинской буквой Z. Оно равно числу элементарных электрических зарядов, содержащихся в заряде ядра данного химического элемента.
Напомним, что под элементарным зарядом мы понимаем наименьший электрический заряд, равный по модулю заряду электрона.
Сразу обращаем ваше внимание на то, что зарядовое и массовое числа всегда целые и положительные. Помимо этого, они не имеют единиц измерения, поскольку указывают, во сколько раз масса и заряд ядра больше единичных.
Таким образом, при бета-распаде ядро атома теряет один электрон, в результате чего образуется ядро нового элемента с тем же самым массовым числом, но с атомным номером на единицу больше, чем у материнского ядра:

Здесь важно понимать, что электрон теряет не атом (в этом случае образовался бы положительный ион), а ядро атома.
Изначально казалось, что при бета-распаде нарушаются два фундаментальных закона: закон сохранения энергии и импульса. Но 4 декабря 1930 года швейцарский физик Вольфганг Эрнст Паули предположил, что при бета-распаде рождается ещё какая-то частица, которая и уносит часть энергии и импульса. Эту частицу предложили назвать нейтрино.
Лишь к середине 50-х годов ХХ в. американскими физиками Фредериком Райнесом и Клайдом Коуэном удалось обнаружить неуловимую частицу и доказать её существование.
Таким образом, при бета-распаде ядра самопроизвольно испускают электрон и электронное антинейтрино. В результате образуется новое ядро с тем же самым массовым числом, но с атомным номером на единицу больше:

В 1900 году французский физик Поль Вийяр при исследовании отклонение альфа- и бета-лучей в излучении радия обнаружил и третий, ранее неизвестный вид лучей, не отклоняющихся даже в самых сильных магнитных полях. Эрнест Резерфорд предложил назвать лучи Вийяра гамма-лучами, потому что они были гораздо более проникающими, чем альфа- и бета-лучи, открытые им ранее. В дальнейшем было доказано, что гамма-излучение представляет собой поток фотонов, имеющих высокую энергию.

Труднее всего было выяснить природу альфа-частиц, так как они слабее отклоняются магнитным и электрическим полями. Окончательно эту задачу удалось решить Резерфорду в 1913 году. Для начала он смог измерить отношение заряда частицы к её массе по отклонению в магнитном поле. Оно оказалось примерно в два раза меньше, чем у протона. Отсюда следовало, что у альфа-частицы на один элементарный заряд приходится масса, равная двум атомным единицам массы.
Затем Резерфорд поместил на пути частиц счётчик Гейгера и с его помощью измерил число частиц, испускаемых радиоактивным препаратом за определённое время. Затем он поставил на место счётчика металлический цилиндр, соединённый с чувствительным электрометром. С помощью электрометра учёный мог измерить заряд частиц, испущенных источником внутрь цилиндра за такое же время, так как радиоактивность многих веществ почти не меняется со временем. Зная суммарный заряд альфа-частиц и их число, Резерфорду не составило труда определить заряд одной альфа-частицы. Он оказался равным двум элементарным. Собрав результаты опытов воедино, учёный установил, что на два элементарных заряда альфа-частицы приходится четыре атомные единицы массы. Такой же заряд и такую же относительную атомную массу имеет ядро гелия. То есть альфа-частица — это ядро атома гелия, потерявшее два своих электрона.
Следовательно, продуктом распада материнского ядра оказывается элемент, зарядовое число которого на две единицы меньше, а массовое число на четыре единицы меньше, чем у материнского ядра:

В том же году году американцем Казимиром Фаянсом и англичанином Фредериком Содди особенности альфа- и бета-распада были сведены в общее правило — правило смещения:
при α-распаде ядро теряет положительный заряд 2е и масса его убывает примерно на 4 а. е. м. В результате элемент смещается на две клетки к началу Периодической системы. При β−распаде элемент смещается на одну клетку ближе к концу Периодической системы.
Также отметим одну очень важную особенность явления радиоактивности: при всех ядерных превращениях сохраняются массовые и зарядовые числа, а также выполняются все известные законы сохранения.

 Получите свидетельство
Получите свидетельство Вход
Вход





 324
324

