Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
· окислительные – ослабевают.
· высшая степень окисления остается неизменной и равна номеру группы
· низшая степень окисления тоже не изменяется и равна № группы – 8.
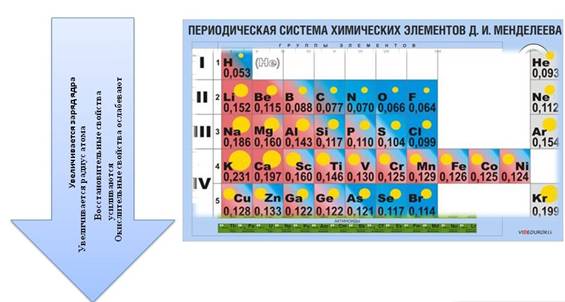
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
· низшая степень окисления изменяется от -4 до -1: в четвертой группе она равна -4, в пятой -3, в шестой -2, а в седьмой -1.
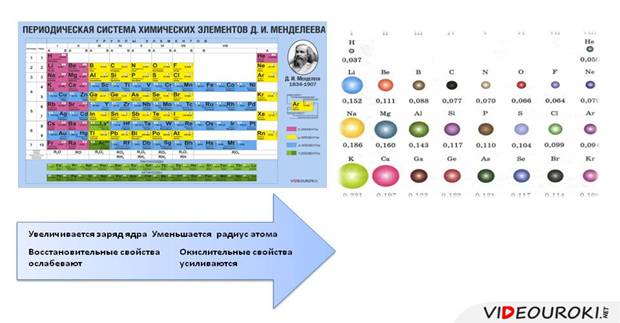

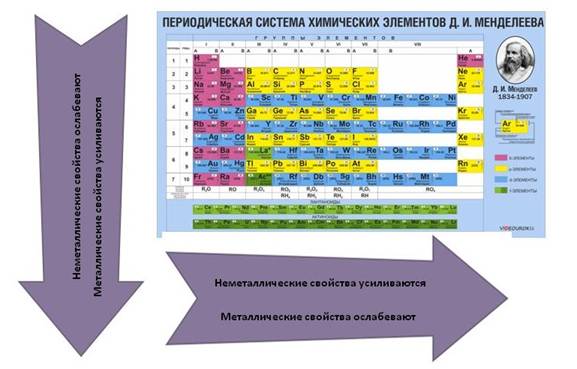
Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах слева направо усиливаются.
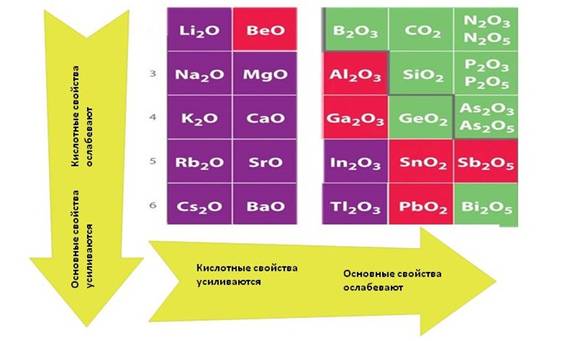
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у оксида алюминия (Al2O3), у оксида углерода (IV) (CO2) – кислотные свойства выражены сильнее, чем у оксида бора (B2O3).
Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
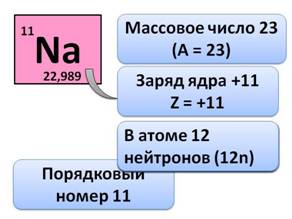
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23

· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
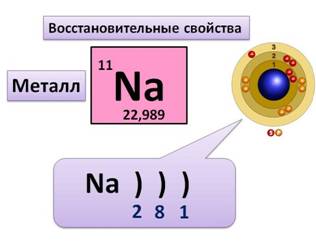

Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.

Сравним свойства натрия со свойствами его соседей по группе: металлические свойства натрия выражены сильнее, чем у лития, но слабее, чем у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у магния, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.

Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.

Натрий – металл, но он не образует летучих водородных соединений.
Охарактеризуем фосфор.
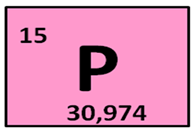
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).

Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
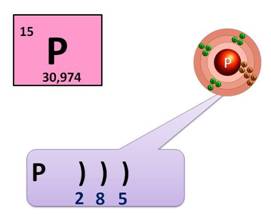
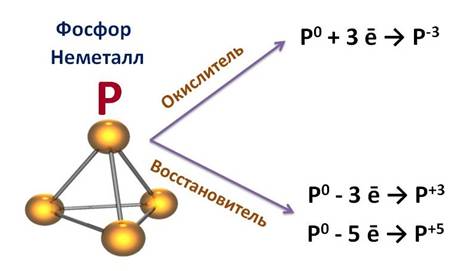
Фосфор – это неметалл, он может быть как окислителем, так и восстановителем. Как окислитель, он может присоединить 3 электрона до завершения внешнего уровня, получая при этом степень окисления -3 (Р0 + 3 ē → Р-3), а как восстановитель, он может отдать 3 или 5 электронов и получить степень окисления +3 или +5 (Р0 - 3 ē → Р+3, Р0 - 5 ē → Р+5).
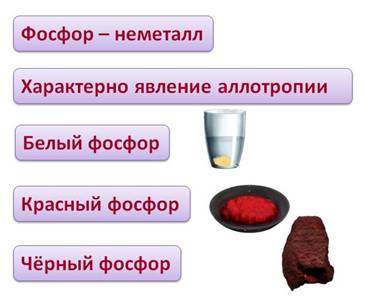
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.

Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.

Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
Нам пришлось потрудиться, но мы смогли выполнить все задание.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 25603
25603

