
Министерство образования Московской области Государственное бюджетное образовательное учреждение высшего образования Московской области «Университет «Дубна» Факультет естественных и инженерных наук
«Соединения железа III»
Выполнил:
ученица 10 «А» класса
МБОУ Гимназия № 8 г. Дубна МО
Голыно Маргарита Николаевна
Научный руководитель:
Кузакова Нина Николаевна,
учитель химии МБОУ Гимназия № 8 г. Дубна МО
Секция:
химия

Цель работы:
изучить состав, получение и свойства соединений железа III .
Задачи:
- изучить строение атома железа;
- изучить физические и химические свойства железа
- познакомиться с соединениями железа II и III;
- сравнить свойства соединений железа II и III;
- получить соединения железа +6;
- научиться распознавать ионы железа 2+ и 3+;
- понять биологическое значение соединений железа .

Методы исследования: научно-теоретический экспериментальный
Рабочая гипотеза:
Изучая литературу о металлах,
я обратила внимание на определенную
закономерность – с увеличением степени окисления металла основные свойства его соединений переходят в кислотные свойства через амфотерные. Соответственно, возник вопрос о свойствах соединений железа III : проявляют они только основные свойства или у них появляются кислотные свойства?

Железо


Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк - гематит , Fe 2 O 3 , магнитный железняк - магнетит , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит , Fe 2 O 3 ·nH 2 O). В природе также широко распространены сульфиды железа — пирит FeS 2 (серный или железный колчедан).
По запасам железных руд Россия занимает первое место в мире.

Строение атома железа

Химические свойства железа
Взаимодействие с неметаллами
Взаимодействие со сложными веществами

Соединения железа
Соединения
оксиды
Fe 2+
основания
FeO
Fe(OH) 2
соли
FeSO 4, FeCl 2
Fe 3 +
Fe(OH) 3
Fe 2 O 3
Fe 2 (SO 4 ) 3 , . FeCl 3

Оксиды железа
FeO Fe(OH) 2
оксид и гидроксид железа(II)
вступают в реакцию
с кислотами:
FeO + H 2 SO 4 = FeSO 4 + H 2 O
Fe(OH) 2 + 2HC1 = FeCl 2 + 2H 2 O
(основные свойства)

Химическая лаборатория кафедры химии университета «Дубна»
Наш руководитель -Плешкова Надежда Анатольевна.

Fe 2 O 3
Fe 2 O 3 + 6HСl = 2FeCl 3 + 3H 2 O,


Cплавление Fe 2 O 3 со щелочами и солями щелочных и щелочноземельных металлов
3
1
2
t
t
t
Fe 2 O 3 + NaOH + NaNО 3
Fe 2 O 3 + Na 2 СO 3
Fe 2 O 3 + NaOH

После обжига
3
1
2

- При сплавление Fe 2 O 3 с твердыми щелочами и карбонатами щелочных и щелочноземельных металлов образуются ферриты , соли не полученной в свободном состоянии железистой кислоты HFeO 2
1.Fe 2 O 3 + 2 NaOH 2 NaFeO 2 феррит натрия
3.Fe 2 O 3 + Na 2 СO 3 2 NaFeO 2 +СO 2
- При сплавление Fe 2 O 3 с твердыми щелочами и нитратами щелочных и щелочноземельных металлов образуются ферраты , соли не полученной в свободном состоянии железистой кислоты H 2 FeO 4
2. Fe 2 O 3 + 4 NaOH + 3 NaNО 3
2Na 2 FeO 4 + 3 NaNО 2 + 2 H 2 O
феррат натрия

Гидроксиды железа
(1) FeSO 4 +2NaOH = Fe(OH) 2 + Na 2 SO 4
(1)
(2)FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
(2)
4Fe(OH
+ O 2
+ 2H 2 O
= 4Fe(OH) 3
Оба гидроксида железа растворяются в кислотах, с образованием солей.
Fe(ОН) 2 + H 2 SO 4 → FeSO 4 + H 2 O.
2Fe(ОН) 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 2 + 6H 2 O.
![Взаимодействие гидроксида железа III с кислотами и щелочами Fe(ОН) 3 1 (1)2Fe(ОН) 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 2 3 + 6H 2 O. 2 (2)Fe(ОН) 3 + 3КОН → К 3 [Fe(ОН) 6 ].](https://fsd.videouroki.net/html/2018/10/14/v_5bc325889c49a/img17.jpg)
Взаимодействие гидроксида железа III с кислотами и щелочами
Fe(ОН) 3
1
(1)2Fe(ОН) 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 2 3 + 6H 2 O.
2
(2)Fe(ОН) 3 + 3КОН → К 3 [Fe(ОН) 6 ].

Соли железа III
FeCl 3
ПОЛУЧЕНИЕ:
2Fe+ 6H 2 SO 4 = Fe 2 (SO 4 ) 3 +3SO 2
+ 6H 2 O.
2Fe+3Cl 2 = 2 FeCl 3
2FeCl 2 + 2HCl+ O 2 = 2FeCl 3 +2H 2 O
соль Мора —
(NH 4 ) 2 Fe(SO 4 ) 2 ·6Н 2 O.

Взаимодействие хлорида железа III с бромом в щелочной среде и йодидом калия
2FeCl 3 +3Br 2 + 16 NaOH = 2Na 2 FeO 4 + 6NaСl + 6NaBr+ 8H 2 O
Fe 3 + - восстановитель
2FeCl 3 + 2Кl = 2FeCl 2 +l 2 + 2КСl
Fe 3 + - окислитель

Ферраты – сильные окислители
K 2 FeO 4
10 K 2 FeO 4 + 6MnSO 4 +16 H 2 SO 4 =
6KMnO 4 +5Fe 2 (SO 4 ) 3 + 7K 2 SO 4 + 16H 2 O
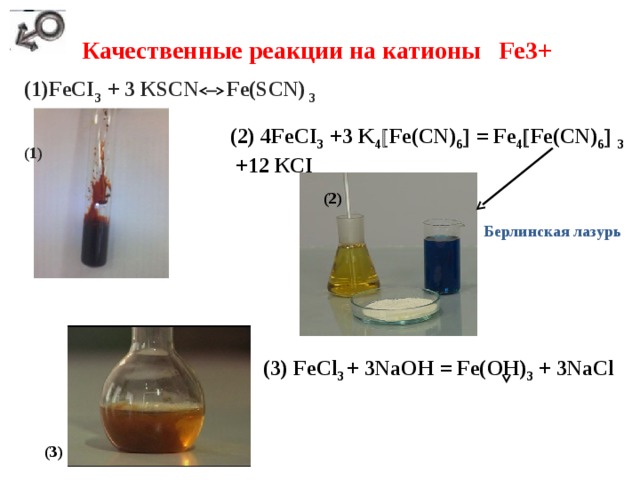
Качественные реакции на катионы Fe3+
(1)FeСI 3 + 3 КSCN Fe(SCN) 3
(2) 4FeСI 3 +3 K 4 Fe(CN) 6 = Fe 4 Fe(CN) 6 3 +12 КСI
(1)
(2)
Берлинская лазурь
(3) FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
(3)

Качественные реакции на катионы Fe2+
(2)
(1)
(1) FeSO 4 +2NaOH =
Fe(OH) 2 + Na 2 SO 4
Турнбулева синь
(2) 3FeСI 2 +2 K 3 Fe(СN) 6 =
Fe 3 Fe(CNH) 6 2 +6 КСI
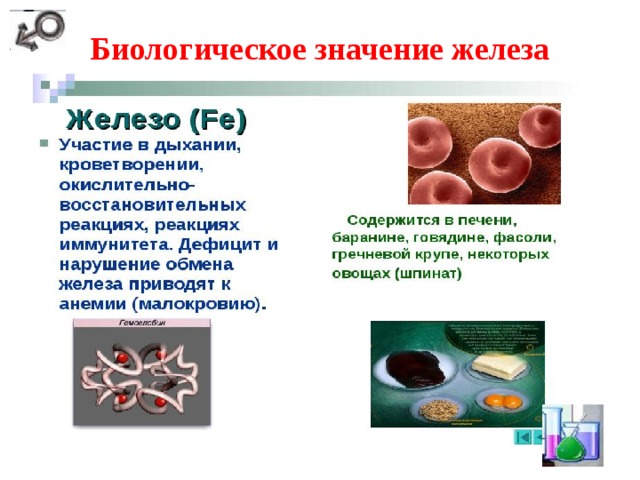
Биологическое значение железа

Биологическое значение железа

Выводы:
- Оксид гидроксид железа II проявляют основные свойства;
- при повышении степени окисления железа свойства оксида и гидроксида железа III изменяются- появляются слабокислотные свойства , те. данные вещества являются амфотерными;
- соединения железа II неустойчивы и легко окисляются до железа III;
- соли железа III могут быть как окислителями, так и восстановителями, так как железо в них находится в промежуточной степени окисления;
- доказать наличие ионов железа III можно с помощью:
- роданид -ионов SCN
- гидроксид –ионов
-желтой кровяной соли
- совокупность специфических свойств железа и его сплавов, биологическое значение железа делают его «металлом № 1» по важности для человека.

Спасибо за внимание!
Fe2+ и Fe3+ (Без ЖЕЛЕЗА – нельзя!!!)

 Получите свидетельство
Получите свидетельство Вход
Вход












 Железо. свойства соединений железа. (2.9 MB)
Железо. свойства соединений железа. (2.9 MB)
 0
0 1023
1023 17
17 Нравится
0
Нравится
0


