Цель урока:
дать понятие об основаниях, выяснить классификацию, их получение, значение для жизни человека и применение;
сформировать умения по составлению формул оснований, закрепить умения по составлению уравнений реакций, продолжить формирование умений и навыков по проведению опытов, формировать умение работать с источниками информации, продолжить формирование критического мышления, умений анализировать, обобщать, выделять главное, делать выводы;
вовлечь в активную практическую деятельность, способствовать воспитанию природо- и культуроохранного, экологического сознания, совершенствовать навыки общения.
Ход урока
Организационный момент.
Проверка домашнего задания :
| Вариант 1 Формула основного оксида А) Na2O Б) CO В) SO3 2. В какой паре оба оксида кислотные: А) СаО, СО2 Б) N2O3, N2O В) SO2, CrО3 Г) N2O5, Cu2O 3. В результате взаимодействия оксида фосфора (V) с водой образуется А) основание Б) кислота В) соль 4. С водой не будет реагировать А) CO2 Б) CaO В) SiO2 5. Коэффициент перед формулой кислорода в уравнении реакции, схема которой Al + O2 → Al2O3 А) 2 Б) 3 В) 4 6. С серной кислотой будет взаимодействовать А) MgO Б) SO2 В) N2O5 7. При реакции Cl2O5 с раствором NaOH образуется: А) NaClO2 Б) NaClO3 В) NaCl | Вариант 2 Формула кислотного оксида А) CO2 Б) CaO В) K2O 2. В какой паре оба оксида основные: А) СаО, K2O Б) N2O3, FeO В) CuO, Cl2O5 Г) ВаO, CrO3 3. В результате взаимодействия оксида натрия с водой образуется А) соль Б) щелочь В) кислота 4. С водой будет взаимодействовать А) CuO Б) FeO В) BaO 5. С гидроксидом натрия будет реагировать А) CuO Б) P2O5 В) CaO 6. При разложении гидроксида железа (III) образуются А) Fe2O3 , H2O Б) FeO , H2O В) Fe , H2O 7. Между собой реагируют: А) NO и P2O3 Б) P2O5 и SO3 В) CO и BaO Г) BaO и SO2
|
Вариант I.
1Напишите уравнения реакций соединения с водой оксидов натрия, углерода (IV), кальция, серы (IV).
2 Напишите уравнения реакции, с помощью которых можно осуществить следующее превращение:
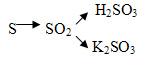
Вариант II.
1 Напишите уравнения реакций оксида серы (IV) с гидроксидом калия и оксида фосфора (V) с гидроксидом бария.
2 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
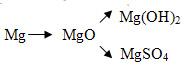
Изучение нового материала
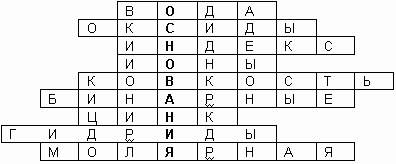
Ребята, предлагаю вам кроссворд, разгадав который, вы узнаете тему нашего урока.
Самый распространенный оксид на Земле.
Вещества, состоящие из двух элементов, один из которых кислород со степенью окисления -2.
Цифры, стоящие внизу справа от химического символа в формулах веществ.
Положительно или отрицательно заряженные частицы, образовавшиеся в результате отдачи или принятия электронов.
Одно из физических свойств металлов.
Соединения, состоящие из двух элементов.
Атом этого химического элемента содержит 30 электронов.
Соединения металлов с водородом.
Масса одного моля вещества.
"В некотором царстве, Химическом государстве, на противоположных сторонах говорливой реки Ионки расположились две деревеньки – Металловка и Гидроксид-ионовка. Жители Металловки всем служили примером: и веселые, и активные, и работящие. Как ни крути – со всех сторон положительные! Так их и называли Катионы Металловы. А жители Гидроксид-ионовки были им полной противоположностью: работать не хотели, всех задирали, со всеми ссорились. Одним словом – Гидроксид-анионы. И решили Катионы Металловы усмирить буйный нрав Гидроксид - анионов; перешли они реку Ионку по мосту Химической связи – и появились вещества новые, Основаниями называемые".
Вот такую сказку сочинили ученики. Давайте попробуем разобраться с точки зрения науки химии, о чем же шла речь в этом повествовании.
| 1. Какие действующие лица? | КАТИОНЫ МЕТАЛЛОВЫ | ГИДРОКСИД-АНИОНЫ |
| 2. С химической точки зрения? | Ионы металлов – простые ионы с зарядом "+" | Ионы ОН – сложные ионы с зарядом "–" |
| 3. Чему равна величина его заряда? | Совпадает со степенью окисления элемента | Совпадает с суммой степеней окисления элементов |
| 4. Как определить? | По таблице растворимости | |
| 5. Какой тип химической связи между ионами в основании? | Ионный | |
| Чтобы не путать степени окисления и заряды ионов: | ||
Сформулируйте определение оснований
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов.
Гидроксид-ион (гидроксогруппа) – сложный ион (О-2Н+1)- Суммарный заряд -1. Валентность 1.
Попробуем узнать среди различных веществ основания: [На доске заранее подготовленный увеличенный вариант "крестиков–ноликов" прорешивается 2 учащимися].
Задание 1.
Поиграйте в "крестики–нолики". Назовите вещества, которые по вашему мнению являются основаниями.
|
| 1 | 2 | 3 | 4 | 5 | 6 |
| А | H2O2 | CuO | H2O | MgCl2 | KOH | Ca(OH)2 |
| В | NaOH | Cu(OH)2 | Mg(OH)2 | CuOH | Ba(OH)2 | Na2O |
| С | Ca(OH)2 | HNO3 | BaSO4 | Fe(OH)2 | CaCO3 | LiOH |
У нас есть вещества, есть их молекулярные формулы. А как же называется каждое из них? Каждый человек имеет свою фамилию, имени, отчество. Так и химические соединения имеют "фамилию", "имя", "отчество".
Чтобы назвать вещество, мы воспользуемся правилом
| слово "гидроксид" |
+ | название металла в родительном падеже |
+ | (римская цифра, обозначающая числовое значение степени окисления металла) для металлов с переменной степенью окисления |
| Формула | Название | Формула | Название |
| LiOH | гидроксид лития | Ca(OH)2 | гидроксид кальция |
| NaOH | гидроксид натрия | Cu(OH)2 | гидроксид меди(II) |
| KOH | гидроксид калия | Fe(OH)3 | гидроксид железа(III) |
Задание 2.
Назовите основания, используя правило, в котором знак "плюс" означает, что из отдельных слов получается название соединения.
Но некоторые основания имеют и другое название. Примером могут служить гидроксиды натрия и калия – едкий натр и едкое кали. Как появились эти названия?
Гидроксид натрия
Что за вещество скрывается под названиями "алкаль", "едкая щелочная соль", "каустик", "каустическая сода"? Так называли в разные времена в России гидроксид натрия. До сих про сохранилось его старое название – едкий натр, предложенное еще в 1807 году русским химиком Александром Ивановичем Шерером. В быту гидроксид натрия именуют каустической содой, хотя к соде отношения он не имеет. Уж лучше его просто называть "каустиком" (от греческого "каустикос" – жгучий, едкий). Раствор и кристаллы очень опасны в обращении: при попадании в пищевод человека всего 0,01–0,02г наступает смерть в первые же часы или сутки. На коже он вызывает глубокие и долго незаживающие ожоги.
Также гидроксид натрия применяют в производстве мыла, в кожевенной промышленности и в фармацевтике и в производстве бумаги.
Гидроксид калия
Как и гидроксид натрия твердое белое вещество. Раствор гидроксида калия мылок на ощупь и очень едок. Поэтому гидроксид калия иначе называют едкое кали. Применяют его в качестве добавки при производстве мыла, тугоплавкого стекла.
Гидроксид кальция
В технической литературе и в быту часто встречаются такие названия веществ: "воздушная", или "негашеная известь", "известковое молоко", "известковая вода". Негашеная известь – это оксид кальция, получаемый при обжиге мела; гашеная известь – это гидроксид кальция, получаемый при обработке оксида кальция водой. Этот процесс протекает с большим выделением теплоты. Известковое молоко – суспензия гидроксида кальция в воде, применяемая для побелки потолков, стен, стволов деревьев по весне для защиты от обморожений и вредных насекомых.
Гидроксид кальция входит в состав "бордосской жидкости" в смеси с медным купоросом для борьбы с возбудителями грибковых заболеваний плодовых, овощных и декоративных культур. Применяется для распознавания углекислого газа.
Гидроксид бария
Гидроксид бария – "баритовая вода" – применяют для качественного и количественного определения содержания углекислого газа в газах.
Рассмотрим образцы этих оснований.
Демонстрация образцов едкого натра, едкого кали
Что произойдет, если опустить несколько таблеток в воду?
Демонстрационный опыт "Растворимость оснований"
Растворяются ли эти вещества?
В трех пронумерованных пробирках содержатся растворы: №1- хлорида железа (II), №2 – хлорида меди (II), №3 – гидроксида натрия.
Прильем к пробиркам №1 и №2 содержимое пробирки №3. Что наблюдаете? (Выпадение осадка разных цветов).
К каким явлениям отнесете? (К химическим реакциям).
По каким признакам? (Выпадение осадка).
Предположите, какие вещества получились в пробирках с выпавшими осадками. (Основания).
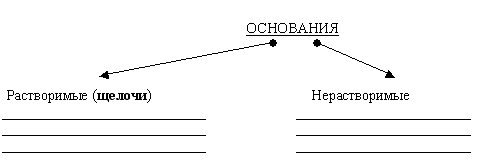
Как можно классифицировать основания? (Растворимые и нерастворимые).
Записать определение в тетрадь:
| Щелочи – растворимые основания |
Основания классифицируют:
по растворимости в воде - растворимые и нерастворимые.
Задание 3.
Заполните схему "Классификация оснований" формулам из задания 2.
по степени электролитической диссоциации – сильные и слабые основания
по кислотности (числу гидроксогрупп) – однокислотные, двухкислотные, трёхкислотные.
КОН – растворимое, сильное, однокислотное основание.
Fe(OH)3 - нерастворимое, слабое, трёхкислотное основание
Ребята, у вас в пробирках №1 и№2 находятся вода и щелочь….. Ой, что же я натворила позабыла подписать этикетки! Предложите ваш вариант, чтобы отыскать пробирку с водой и со щелочью (проблемная ситуация)
Нам в таких ситуациях помогают индикаторы (указатели) – вещества, изменяющие окраску в зависимости от среды.
| Индикатор | Нейтральная среда | Щелочная среда | Кислая среда |
| Лакмус | Фиолетовый | Синий | Красный |
| Метиловый оранжевый | Оранжевый | Желтый | Розовый |
| Фенолфталеин | Бесцветный | Малиновый | Бесцветный |
Самым первым появился индикатор лакмус. Лакмус – это водный настой лакмусового лишайника, растущего на скалах в Шотландии. Этот индикатор случайно открыл в 1663 году английский физик и химик Роберт Бойль. Позднее лакмусовым настоем стали пропитывать фильтровальную бумагу; ее высушивали и получали таким образом "лакмусовые бумажки".
Демонстрационный опыт
"Испытание растворов гидроксидов индикаторами".
Фенолфталеиновый от щелочи малиновый.
Ах, что же я поделаю с собой – ведь в щелочи я сине-голубой (лакмус).
Вид мой в щелочи смешон: я сразу желтый как лимон (метилоранж).
Вывод: индикаторы распознают в растворе гидроксид-ионы.
Лабораторный опыт "Определение известковой воды с помощью углекислого газа"
А еще одно основание, всем вам хорошо известное, можно определить другим способом:
В пробирке №4 находится известковая вода Са(ОН)2. Пропустите через стеклянную трубочку, опущенную в пробирку №4, углекислый газ, который образуется при вашем дыхании. Что наблюдаете?
Данная реакция называется качественной реакцией.
| Реакция, в ходе которой доказывается наличие данного вещества или иона, называется качественной |
Вещество, с помощью которого доказывают присутствие другого вещества, называют реактивом на распознаваемое вещество. Реактив может быть не только на одно вещество, но и на группу и целый класс веществ.
Т.о., индикаторы – это также реактивы на растворимые основания.
Еще раз послушаем название изучаемого сегодня класса неорганических соединений:
гидроксиды = оксид +"гидра" (вода).
Следовательно, каждому оксиду соответствует свой оксид. Например, ![]()
Правило: степени окисления элемента в оксиде и соответствующем ему гидроксиде равны.
Задание 3. Составьте формулы оксидов, соответствующих гидроксидами.
А) гидроксид натрия _______________следовательно оксид –
Б) гидроксид железа (III) ____________следовательно оксид –
В) гидроксид меди (II) ______________ следовательно оксид –
Получение гидроксидов
Осуществите превращения. Сделайте вывод о возможных способах получения оснований:
Са → Са(ОН)2 ← СаО
Са + Н2О НЕ ПОЙДЁТ Са(ОН)2
СаО + Н2О = Са(ОН)2
Zn → ZnO → Zn(OH)2 ←ZnCl2
ZnCl2 + Н2О =
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra)
2. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА – щелочного металла (Li, Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ + ЩЁЛОЧЬ = новое ОСНОВАНИЕ + новая СОЛЬ
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Итак, мы сегодня с вами познакомились с новым классом неорганических соединений. Большой багаж знаний вы получили. Теперь очень важно этот багаж рассортировать, разложить по полочкам, чтобы ни одна крупица не была потеряна. Для этого попытайтесь честно ответить на вопросы таблицы, поставив плюс в той колонке, которая, наиболее реально соответствует вашему уровню усвоения сегодняшнего материала.
Закрепление полученных ЗУН
№1. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их :
MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
№2. Приведите по два уравнения реакций получения следующих оснований:
1) Гидроксид калия
2) Гидроксид кальция
3) Гидроксид железа (III)
Домашнее задание: п.19, задание№ 4,5(ж).

 Получите свидетельство
Получите свидетельство Вход
Вход












 Урок химии в 8 классе по теме "Основания" (162 KB)
Урок химии в 8 классе по теме "Основания" (162 KB)
 0
0 459
459 75
75 Нравится
0
Нравится
0


