

Классификация кислот, химические свойства кислот
Н 2 S , Zn О, Н 2 C О 3 , Zn(OH) 2 , Н 2 SO 4 , К NO 3 , Н NO 3 , Н Cl , Са Cl 2 , H 3 РО 4 .

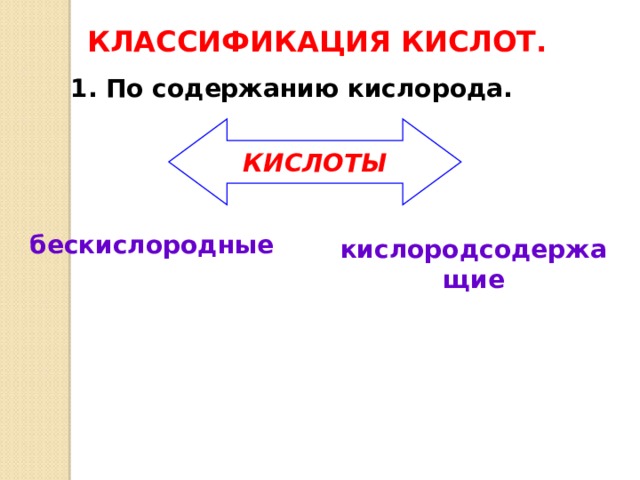
КЛАССИФИКАЦИЯ КИСЛОТ.
1. По содержанию кислорода.
КИСЛОТЫ
бескислородные
кислородсодержащие
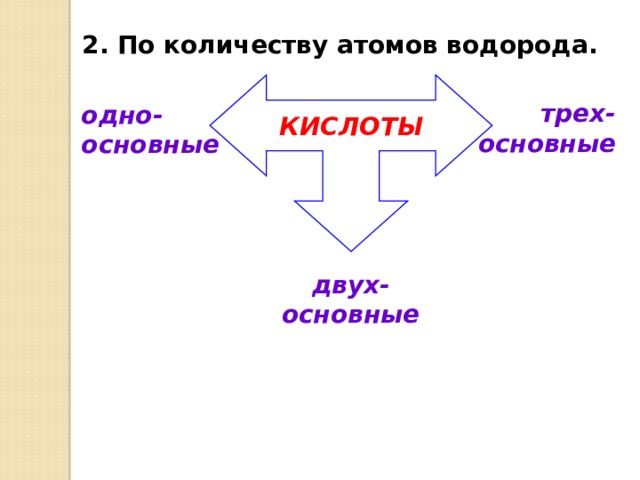
КИСЛОТЫ
2. По количеству атомов водорода.
трех-основные
одно-основные
двух-основные

Что такое кислоты с позиции ТЭД?
Кислоты – это электролиты , диссоциирующие на катионы Н и анионы кислотного остатка
+

Физические свойства кислот
- Кислоты –едкие жидкости (кроме кремневой), с кислым вкусом, без цвета, без запаха .

Техника безопасности при работе с кислотами:
- Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
- Заполнять пробирку можно не больше, чем на 1/3 объема.
- Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем.
- При разбавлении кислот надо вливать аккуратно кислоту в воду, а не наоборот.
- Попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем раствором питьевой соды и вновь смыть водой.

Химические свойства кислот Кисл+Инд.mpg
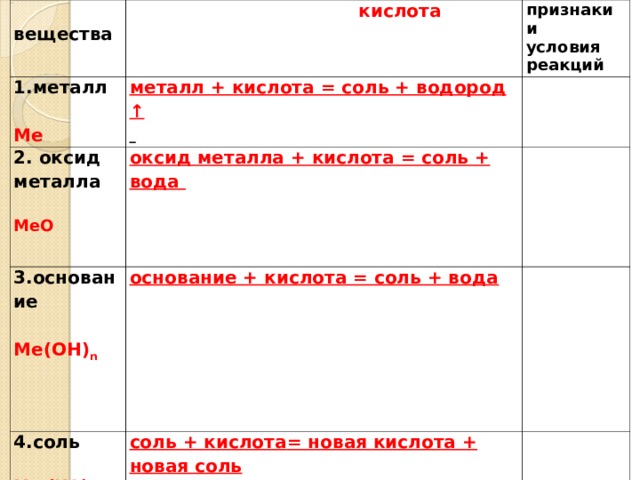
вещества
кислота
1.металл
признаки и
условия реакций
Ме
металл + кислота = соль + водород ↑
2. оксид металла
МеО
оксид металла + кислота = соль + вода
3.основание
Ме(ОН) n
4.соль
основание + кислота = соль + вода
соль + кислота = новая кислота + новая соль
Ме n (КО) m

Проверьте себя:
- 2 N аОН + Н2 SO4=N а 2SO4 + 2 Н2 O
- ВаС l 2 + Н2 SO4= Ва SO4 + 2 НС l
- Ca О + Н2 SO4= CaSO4 + Н2О
- К2SiО3 + Н2 SO4= К2SО 4 + Н2SiО3
- Fе(ОН) 2 + Н2 SO4= FеSО 4 + 2 Н2 O

Проверьте себя:
- Fе O + Н2 SO4= Fе SO4 + Н2 O
- Ва (NO3) 2 + Н2 SO4= Ва SO4 + 2 Н NO3
- Ca( О H) 2 + Н2 SO4= CaSO4 + 2 Н2О
- Pb(N О3 )2 + Н2 SO4= Pb SО 4 + 2 Н N О3
- Zn + Н2 SO4= Zn SО 4 + Н2

Домашнее задание
§ 39 №4. Предложите различные способы получения следующих кислот: НС l, H 2 S, H 2 SO 4

БЛАГОДАРЮ ЗА УРОК ! УСПЕХА!

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация по теме: Химические свойства кислот (1.69 MB)
Презентация по теме: Химические свойства кислот (1.69 MB)
 0
0 551
551 101
101 Нравится
0
Нравится
0


