
Тема: Оксиды, их классификация и свойства
Сложные вещества (неорганические)
Оксиды Основания Кислоты Соли

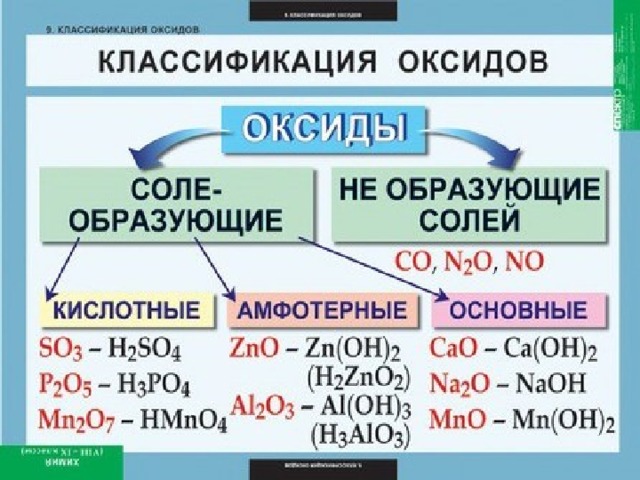
Оксиды- это сложные соединения, состоящие из двух элементов, один из которых кислород со степенью окисления -2.
Общая формула оксидов: ЭхОу.
Примеры оксидов: FeO, Al 2 O 3 , SO 2 , SO 3 , CuO, NO, Fe 2 O 3 , CO 2 , SiO 2 , P 2 O 5 , MgO

Агрегатное состояние оксидов:
При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe 2 O 3 и др.), некоторые - жидкости (Н 2 О, Сl 2 О 7 и др.) и газы (NO, SO 2 и др.).

Химические свойства оксидов
основных
кислотных
1. Основные оксиды взаимодействуют с кислотами, получаются соль и вода:
CuO + H 2 S0 4 →CuS0 4 + Н 2 0
1. Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода:
2. Оксиды активных металлов взаимодействуют с водой с образованием щелочи:
С0 2 + Са(ОН) 2 →СаС0 3 ↓+Н 2 0
Li 2 0 + H 2 0→2LiOH
2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли:
P 2 05 + 3H 2 0→2H 3 P0 4
СаО + С0 2 →СаСОз
4. Менее летучие кислотные оксиды вытесняют более летучие из их солей:
СаСOз + SiO 2 →CaSi0 3 + C0 2 ↑
 S0 2 ; 4A1 + 30 2 — 2А1 2 0 3 ; 2.Термическое разложение оснований, солей, кислот. Примеры: СаСО 3 — СаО + С0 2 ; 2Н 3 В0 3 — В 2 0 3 + Н 2 0 ; Mg(OH) 2 — MgO + Н 2 0; З.Взаимодействие простых веществ и солей с кислотами-окислителями. Примеры: С + 4HN0 3 (p-p) — С0 2 + 4N0 2 + H 2 0; Сu+ 4НNO 3 (конц,) — Cu(N0 3 ) 2 + 2N0 2 + 2H 2 0; Na 2 S0 3 + 2H 2 S0 4 — 2NaHS0 4 + S0 2 + H 2 0. " width="640"
S0 2 ; 4A1 + 30 2 — 2А1 2 0 3 ; 2.Термическое разложение оснований, солей, кислот. Примеры: СаСО 3 — СаО + С0 2 ; 2Н 3 В0 3 — В 2 0 3 + Н 2 0 ; Mg(OH) 2 — MgO + Н 2 0; З.Взаимодействие простых веществ и солей с кислотами-окислителями. Примеры: С + 4HN0 3 (p-p) — С0 2 + 4N0 2 + H 2 0; Сu+ 4НNO 3 (конц,) — Cu(N0 3 ) 2 + 2N0 2 + 2H 2 0; Na 2 S0 3 + 2H 2 S0 4 — 2NaHS0 4 + S0 2 + H 2 0. " width="640"
Получение оксидов
1.Взаимодействие простых веществ с кислородом. Примеры: S + 0 2 — S0 2 ; 4A1 + 30 2 — 2А1 2 0 3 ;
2.Термическое разложение оснований, солей, кислот.
Примеры: СаСО 3 — СаО + С0 2 ;
2Н 3 В0 3 — В 2 0 3 + Н 2 0 ; Mg(OH) 2 — MgO + Н 2 0;
З.Взаимодействие простых веществ и солей с
кислотами-окислителями.
Примеры: С + 4HN0 3 (p-p) — С0 2 + 4N0 2 + H 2 0; Сu+ 4НNO 3 (конц,) — Cu(N0 3 ) 2 + 2N0 2 + 2H 2 0;
Na 2 S0 3 + 2H 2 S0 4 — 2NaHS0 4 + S0 2 + H 2 0.

Спасибо за внимание!


 Получите свидетельство
Получите свидетельство Вход
Вход









 S0 2 ; 4A1 + 30 2 — 2А1 2 0 3 ; 2.Термическое разложение оснований, солей, кислот. Примеры: СаСО 3 — СаО + С0 2 ; 2Н 3 В0 3 — В 2 0 3 + Н 2 0 ; Mg(OH) 2 — MgO + Н 2 0; З.Взаимодействие простых веществ и солей с кислотами-окислителями. Примеры: С + 4HN0 3 (p-p) — С0 2 + 4N0 2 + H 2 0; Сu+ 4НNO 3 (конц,) — Cu(N0 3 ) 2 + 2N0 2 + 2H 2 0; Na 2 S0 3 + 2H 2 S0 4 — 2NaHS0 4 + S0 2 + H 2 0. " width="640"
S0 2 ; 4A1 + 30 2 — 2А1 2 0 3 ; 2.Термическое разложение оснований, солей, кислот. Примеры: СаСО 3 — СаО + С0 2 ; 2Н 3 В0 3 — В 2 0 3 + Н 2 0 ; Mg(OH) 2 — MgO + Н 2 0; З.Взаимодействие простых веществ и солей с кислотами-окислителями. Примеры: С + 4HN0 3 (p-p) — С0 2 + 4N0 2 + H 2 0; Сu+ 4НNO 3 (конц,) — Cu(N0 3 ) 2 + 2N0 2 + 2H 2 0; Na 2 S0 3 + 2H 2 S0 4 — 2NaHS0 4 + S0 2 + H 2 0. " width="640"










 Презентация по химии "Оксиды, их классификация и свойства" (0.93 MB)
Презентация по химии "Оксиды, их классификация и свойства" (0.93 MB)
 0
0 2480
2480 331
331 Нравится
0
Нравится
0


