
Основания, их состав и классификация. Химические свойства и применение оснований.
8 класс
Преподаватель:
Жиенгалиева Айдана Болатовна

Запомни!
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН).
Например: NaOH , Ca(OH) 2 , Fe(OH) 3 …
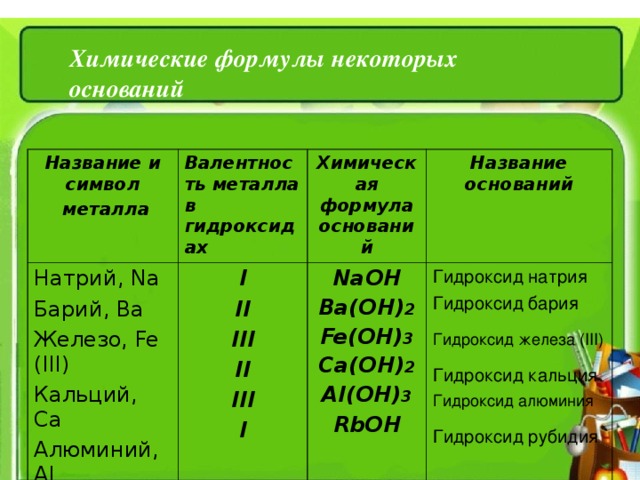
Химические формулы некоторых оснований
Название и символ
металла
Валентность металла в гидроксидах
Натрий , Na
Барий , Ва
Железо , Fe (III)
Кальций, Са
Алюминий , Al
Рубидий ,Rb
I
II
III
II
III
I
Химическая формула оснований
Название оснований
NaOH
Ba(OH) 2
Fe(OH) 3
Са (OH) 2
Al(OH) 3
RbOH
Гидроксид натрия
Гидроксид бария
Гидроксид железа ( III )
Гидроксид кальция
Гидроксид алюминия
Гидроксид рубидия

Укажите соответствующие названия данным основаниям
KOH
Гидроксид кальция
Гидроксид железа (III)
Mg(OH) 2
Ca(OH) 2
Г идроксид натрия
Г идроксид магния
Fe(OH) 3
NaOH
Г идроксид калия
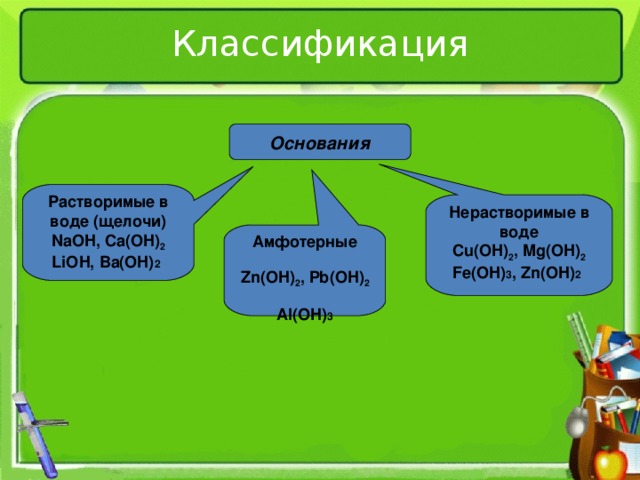
Классификация
Основания
Растворимые в воде (щелочи)
NaOH , Ca(OH) 2
LiOH, Ba(OH) 2
Нерастворимые в воде
Cu(OH) 2 , Mg(OH) 2
Fe(OH) 3 , Zn(OH) 2
Амфотерные
Zn(OH) 2 , Pb(OH) 2
Al(OH) 3
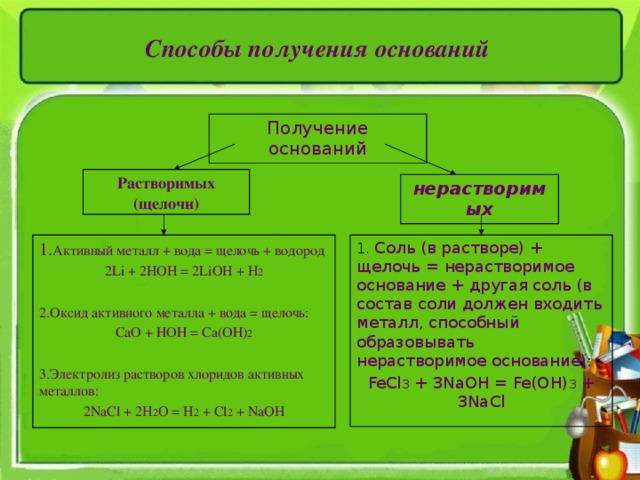
Способы получения оснований
Получение оснований
Растворимых (щелочи)
нерастворимых
1. Активный металл + вода = щелочь + водород
2 Li + 2HOH = 2LiOH + H 2
2. Оксид активного металла + вода = щелочь:
СаО + НОН = Са(ОН) 2
3.Электролиз растворов хлоридов активных металлов:
2 NaCl + 2H 2 O = H 2 + Cl 2 + NaOH
1. Соль (в растворе) + щелочь = нерастворимое основание + другая соль (в состав соли должен входить металл, способный образовывать нерастворимое основание):
FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
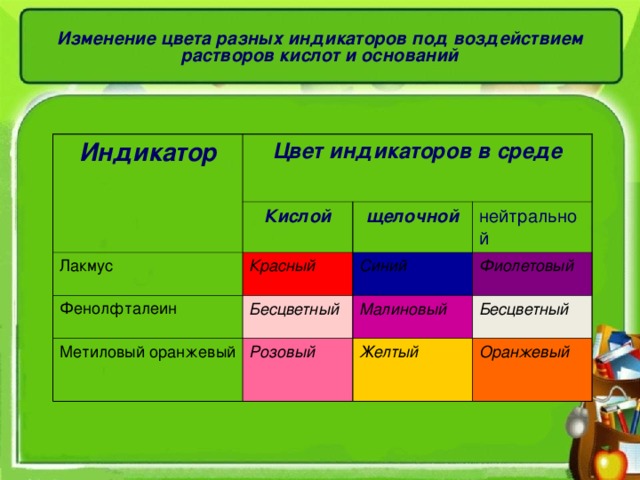
Изменение цвета разных индикаторов под воздействием растворов кислот и оснований
Индикатор
Цвет индикаторов в среде
Кислой
Лакмус
щелочной
Красный
Фенолфталеин
Бесцветный
нейтральной
Метиловый оранжевый
Синий
Малиновый
Фиолетовый
Розовый
Бесцветный
Желтый
Оранжевый

Химические свойства оснований
- основание + кислота = соль + вода ( р-я нейтрализации)
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O
- щелочь + кислотный оксид = соль + вода
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
- щелочь + соль = новая соль + нерастворимое основание
3NaOH + FeCl 3 = 3NaCl + Fe(OH) 3
4. Нерастворимые в воде основания при нагревании разлагаются на оксид и воду
Cu(OH) 2 = t С uO + H 2 O

Применение
NaOH - г идроксид натрия ( едкий натр, каустическая сода ) , применяется в промышленности для изготовления мыла, искусственного шелка, бумаги, красителей, а также для очистки бензина, керосина и т.д.
КОН – гидроксид калия, как и едкий натр, применяется главным образом для изготовления мыла, но только жидкого…
Са(ОН) 2 – гидроксид кальция (гашенная известь) широко используется в строительном деле. При смешивании его с водой образуется так называемое известковое молоко, которое широко используют в химической промышленности, например при производстве сахара, соды и т.д

Проверь свои знания
Закончите уравнения химических реакций, схемы которых приведены ниже:
1. К OH + HCl =
2. Zn(OH) 2 + HCl =
3. NaOH + SO 2 =
4. MgSO 4 + NaOH =
5. Cu(OH) 2 =

Урок окончен!
Спасибо за внимание!

 Получите свидетельство
Получите свидетельство Вход
Вход























 Презентация по химии на тему "Основания, их состав и классификация. Химические свойства и применение оснований" (0.88 MB)
Презентация по химии на тему "Основания, их состав и классификация. Химические свойства и применение оснований" (0.88 MB)
 0
0 1747
1747 219
219 Нравится
0
Нравится
0


