История становления понятия.
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
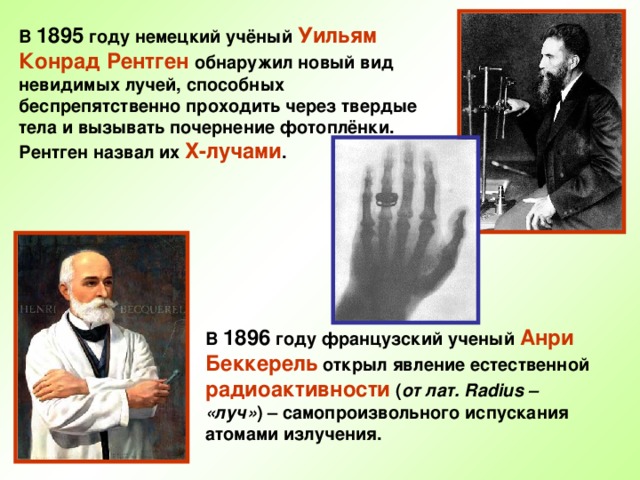
В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить через твердые тела и вызывать почернение фотоплёнки. Рентген назвал их Х-лучами.

В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности (от лат. Radius – «луч») – самопроизвольного испускания атомами излучения.
В 1898 году Пьер Кюри и Мария Склодовская – Кюри, изучавшие явление радиоактивности, открыли новые элементы – полоний и радий.
Демокрит.
В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия». Кусочки материи.
Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.

 Получите свидетельство
Получите свидетельство Вход
Вход






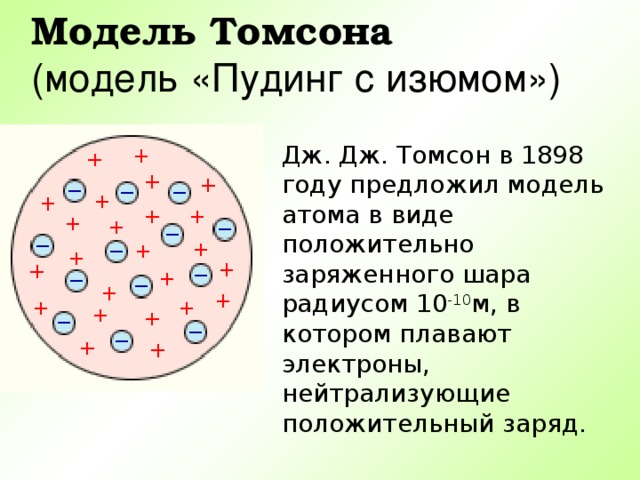

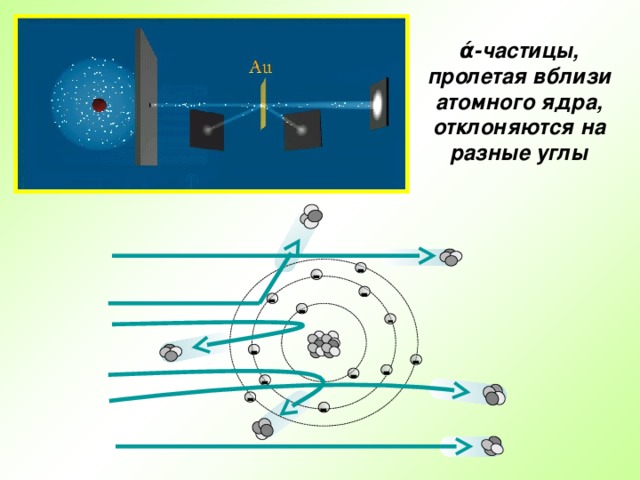

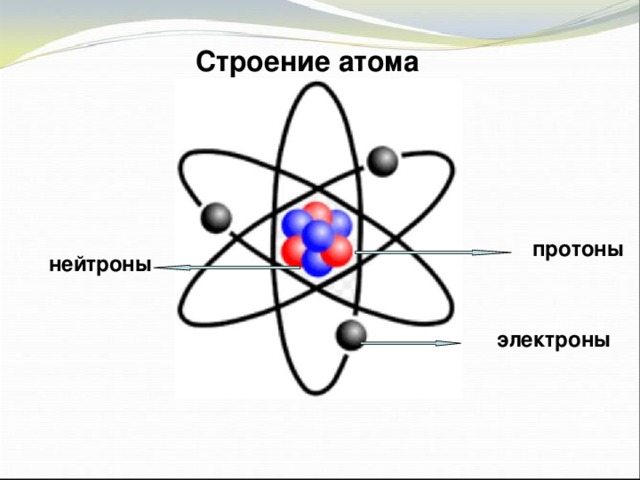
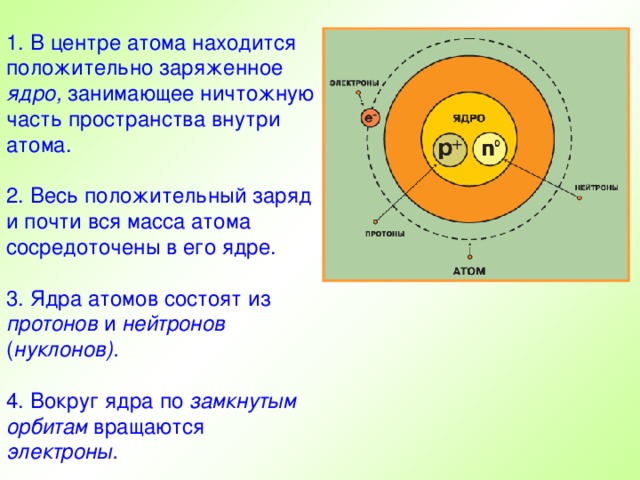
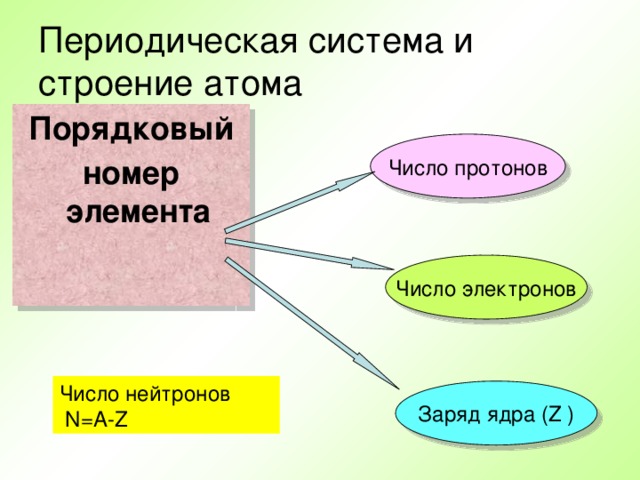
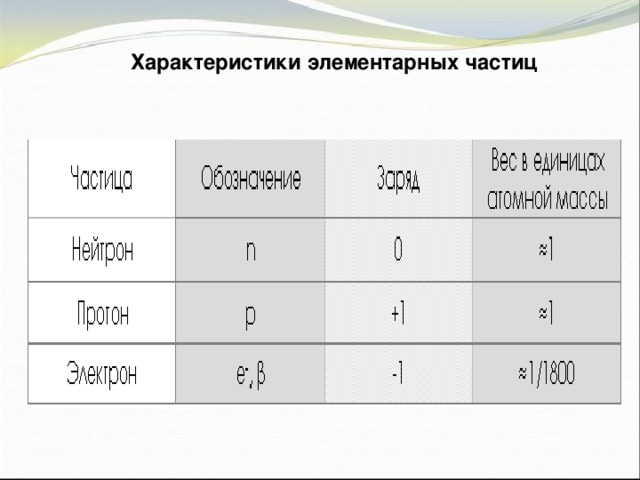











 Презентация по физике по теме "Строение атома" (0.53 MB)
Презентация по физике по теме "Строение атома" (0.53 MB)
 0
0 898
898 107
107 Нравится
0
Нравится
0


