
Практическая работа №3 по теме:«Получение соляной кислоты и изучение её свойств».
17.11.2016г.

Правила техники безопасности при работе с веществами и растворами.
- Наливать или насыпать вещества можно только над столом или специальным подносом. Для опыта брать только указанное количество вещества.
- Нельзя ошибочно взятый излишек реактива ссыпать (выливать) обратно в склянку или банку.
- Все работы, связанные с выделением вредных газов или паров, проводить только в вытяжном шкафу при исправной вентиляции.
- Твердые сыпучие реактивы можно брать только совочками, шпателями, но не руками. Измельчение твердых веществ разрешается проводить только в ступке с помощью пестика.
- Обо всех случаях разлива жидкостей, а также о рассыпанных твердых реактивах нужно сообщить учителю. Место разлива следует обработать нейтрализующим раствором, а затем промыть водой.
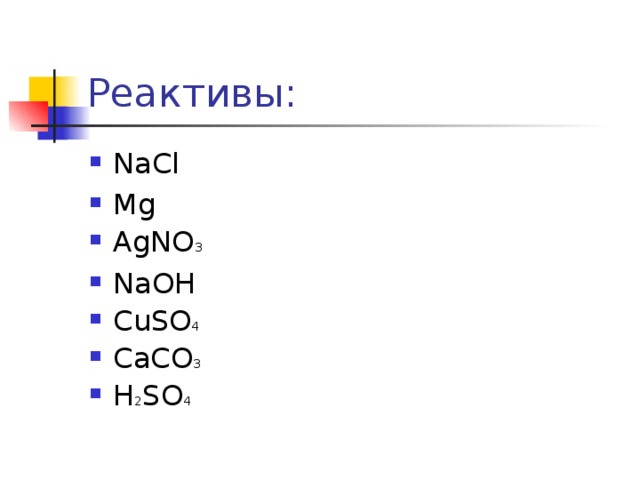
Реактивы:
- NaCl
- Mg
- AgNO 3
- NaOH
- CuSO 4
- CaCO 3
- H 2 SO 4

Оборудование:
- пробирки в штативе,
- газоотводная трубка,
- спиртовка,
- штатив.
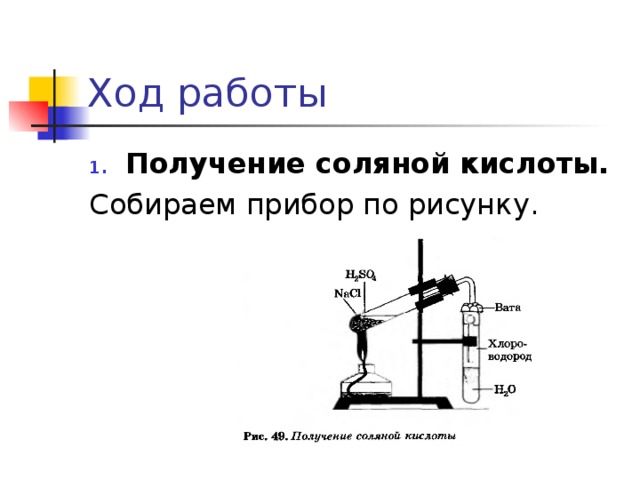
Ход работы
- Получение соляной кислоты.
Собираем прибор по рисунку.

Наблюдения:
- Записать уравнение реакции получения соляной кислоты.
- Почему «Получение хлороводорода» необходимо проводить в вытяжном шкафу?

Сравнительная характеристика хлороводорода и соляной кислоты. (устно)
Хлороводород
Соляная кислота

Ход работы:
2. Свойства соляной кислоты.
В четыре пробирки налейте соляную кислоту.
- В первой пробирке определите среду раствора (рН) универсальным индикатором. Напишите уравнение электролитической диссоциации соляной кислоты. Отметьте окраску индикаторов и среду рН.
HCL ……+…..
- Во вторую пробирку положить гранулу магния Отметьте, что происходит. Составьте уравнение протекающей реакции, коэффициенты расставьте методом электронного баланса.
HCL +Mg ……+…..

Ход работы
- В третью – свежеприготовленного гидроксида меди. Отметьте, что происходит. Составьте уравнение протекающей реакции.
… ..+….. Cu(OH) 2 +……
HCL + Cu(OH) 2 ……+…..

Ход работы
- В четвертую пробирку добавьте немного мела. Что наблюдаете? Напишите молекулярные, полные и сокращенные ионные уравнения реакций.
HCL + CaCO 3 ……+…..

3. Качественная реакция.
- HCL + AgNO 3 ……+….
Напишите молекулярные, полные и сокращенные ионные уравнения реакций.
Что наблюдаете?

4.Экспериментальная задача
- В трех пробирках без этикеток содержатся прозрачные растворы NaCl , Н Cl , Н 2 О.
- Определите каждое из предложенных веществ.
- Выполните практическую часть эксперимента.

ВЫВОД.
1) Хлороводород - это:
а) жидкость; б) газ, легко растворимый в воде;
в) газ, без запаха; г) газ, тяжелее воздуха.
2) В реакцию с соляной кислотой вступает каждый из двух металлов:
а) Hg и Ag ; б) Mg и Zn ; в) Au и Cu ; г) Zn и Ag .
3) Необратимо протекает реакция ионного обмена между растворами
а) хлорида калия и серной кислоты;
б) нитрата серебра и хлорида железа ( III) ;
в) соляной кислоты и сульфата аммония;
г) карбоната калия и гидроксида натрия.
4) Соляная кислота реагирует с
а) H 2 S ; б) AgNO 3 ; в) Ag ; г) Н 2 О
5) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cl 2 → HCl → Na Cl → AgCl .

 Получите свидетельство
Получите свидетельство Вход
Вход












 Практическая работа №3 "Получение соляной кислоты и её свойства" (325.5 KB)
Практическая работа №3 "Получение соляной кислоты и её свойства" (325.5 KB)
 0
0 11739
11739 254
254 Нравится
0
Нравится
0


