Игра «Химические свойства кислот»
“Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”.
М.В. Ломоносов
“Просто знать – еще не все, знания нужно уметь использовать”
Гёте И.В.
Тип урока: урок-практикум.
Вид урока: экспериментально-поисковый с элементами дидактической игры.
Цель урока: на основе экспериментальных опытов изучить химические свойства кислот.
Задачи урока:
- обеспечить усвоение обучающимися химических свойств кислот;
- отработать навыки составления уравнений реакций, характеризующих химические свойства кислот;
- формировать умения выделять существенные признаки и свойства кислот, развивать синтезирующее мышление;
- повысить технику химического эксперимента обучающихся;
- выявить способность применения опорных знаний;
- воспитывать положительное отношение к знаниям.
Форма урока: “детективное расследование” химических свойств кислот, основанное на ранее изученных темах.
Оборудование: таблица для отслеживания результатов, реактивы: растворы H2SO4, NaOH, CuО, Zn, Cu, ZnО, Cu(OH)2, лакмус, ряд активности металлов, таблица “Неорганические кислоты”.
Ход урока.
Учитель:
- Я хочу начать наш урок с эпиграфа: “Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”. Это изречение принадлежит великому русскому учёному М.В. Ломоносову. Из этих слов становится ясно, какую значимость придавал он опыту. Именно поэтому Михаил Васильевич в течение 7 лет настойчиво добивался организации химической лаборатории. “Профессор химии без лаборатории никакой пользы учинить не может, точно также, как профессор астрономии без обсерватории”.
В итоге первая химическая лаборатория была учреждена в России в 1748 г. В ней было выполнено большое количество исследований, было сделано много открытий.
Не случайно наш урок начался со слов этого великого учёного. Сегодня мы с вами будем работать в рамках химической лаборатории, в которой, как и М.В. Ломоносов, будем проводить исследования.
- Сегодня мы с вами открываем “Школу криминалистов”. Цель работы данной школы – на основе экспериментальных опытов изучать химические свойства неорганических веществ.
(Происходит формирование команд. Весь класс делится на три группы. Каждая команда занимает определенный стол.)
- Итак, команды сформированы, можно приступать к испытанию. Для того чтобы определить смогут ли претенденты стать настоящими криминалистами будет работать группа экспертов (из числа присутствующих на уроке), а результаты – заноситься в таблицу (таблица на доске):
команда/тур К-1 К-2 К-3
I
II
III
IV
Учитель:
- Все претенденты на местах, прежде чем приступать к испытаниям, вспомним “Правила безопасности” (Учитель раздает на каждый стол инструкции по технике безопасности при работе с кислотами и обсуждает основные моменты техники безопасности). Можно приступить к испытаниям.
I тур: Найди преступника
Учитель: На месте ограбления был найден кусочек ткани, пропитанный чем-то красным. При его изучении стало ясно, что он принадлежит преступнику. Дальнейшее расследование помогло обнаружить место работы предполагаемого преступника – один из химических заводов, где и произошло ограбление.
Химический завод имеет 3 цеха. В каждом из них использовалось одно из перечисленных веществ: серная кислота, гидроксид натрия, вода. Помогите следствию уменьшить область поиска преступника, определите цех, в котором он работает.
Цех № 1 – вода;
Цех № 2 – гидроксид натрия;
Цех № 3 – серная кислота.
Учащиеся выполняют лабораторное исследование.
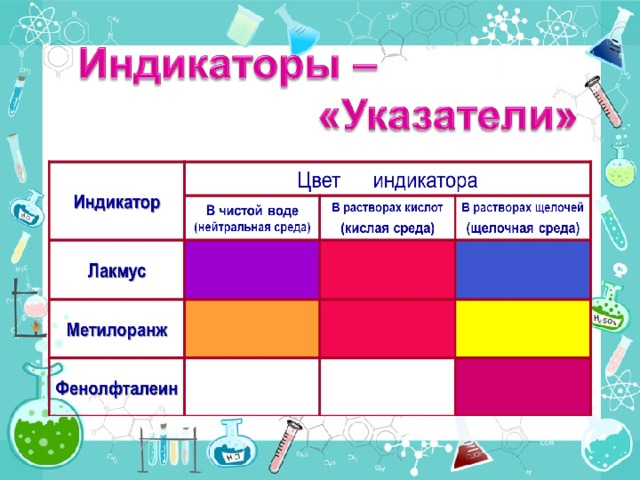
В 3-х пробирках под номерами 1, 2 и 3 находятся серная кислота, гидроксид натрия и вода. Необходимо при помощи лакмусовой бумажки (или метилового оранжевого) определить, в какой пробирке находится кислота. Оформить исследование можно таким способом:
Вещество Цвет индикатора
H2SO4 красный
NaOH синий
Н2О не изменился
Учитель: в каком же цехе работает преступник?
Ответ: в цехе № 3 – серная кислота.
Конкурс оценивается по трехбалльной системе, учитывая время, затраченное на определение вещества.
Учитель: Для того, чтобы стать хорошим криминалистом необходимо уметь составлять фоторобот преступника и уметь правильно сделать описание места преступления. И вам сейчас предстоит составить описание “внешности преступника”.
II тур: Узнай преступника.
На демонстрационном столе растворы кислот: серной, соляной и азотной. К раствору каждой кислоты учитель приливает лакмус или метиловый оранжевый.
Вопрос I команде: Какие вещества находятся в пробирках? Дайте определения кислотам.
Ответ: кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
Вопрос II команде: Какой состав имеют кислоты?
Ответ: в состав кислот входит водород и кислотный остаток.
Вопрос III команде: По каким признакам классифицируют кислоты?
Ответ: по числу атомов водорода – одноосновные и многоосновные, по присутствию кислорода – кислородосодержащие и бескислородные.
Вопрос I команде: Как определить заряд иона кислотного остатка?
Ответ: по числу атомов водорода.
Вопрос II команде: Как изменится цвет лакмуса при добавлении его в кислоту?
Ответ: он станет красным.
Вопрос III команде: Все кислоты растворяются в воде?
Ответ: нет.
За каждый правильный ответ команда получает 1 балл, если команда не отвечает, вопрос передается другой команде.
Учитель: Описать предметы преступника вы можете. Молодцы! А вот сможете ли вы, узнать подозреваемого в “лицо”? Вот вам следующее задание.
Далее выполняется тренировочное упражнение с использованием приемов развития творческих способностей.
Задание I команде: Исправьте формулы веществ:
H2Cl , H2PO3, H3NO3 , HSO4 , H2CO4
Ответ: HCl, H3PO4, HNO3, H2SO4, H2CO3
Задание II команде: Напишите правильные формулы веществ, переставив фрагменты местами: PO4H3 , SH2O4 , NHO3 , O3CH2 , CIH
Ответ: H3PO4, H2SO4 , HNO3 , H2CO3 , HCI
Задание III команде: Игра “Третий лишний”. В каждом ряду выберите одно вещество лишнее:
а) HCI, H3PO4, СаО;
б) H2O, HCI, HNO3 ;
в) HCI, HNO3, H2S;
г) СО2, H2CO3, CO;
д) NaOH, NaCI, KOH.
Ответ: а) СаО; б) H2O; в) HNO3 г) H2CO3 д) NaCI
Правильный ответ оценивается в 1 балл.
Учитель: Любой детектив должен не только уметь сделать описание преступника, но и провести следственный эксперимент. И такой эксперимент вы сейчас проведете.
III тур: Следственный эксперимент.
Каждая команда получает карточку с заданием, результат исследования оформляет в таблицу:
Что делали? Что наблюдали Уравнения реакций
Учитель: Но прежде чем, приступить к заданию, вспомните правила техники безопасности при работе с кислотами и основаниями.
Ребята читают инструктаж по технике безопасности на карточках группы на столе.
Учитель: А теперь получите инструктивные карточки и начинайте эксперимент.
Задания для команд:
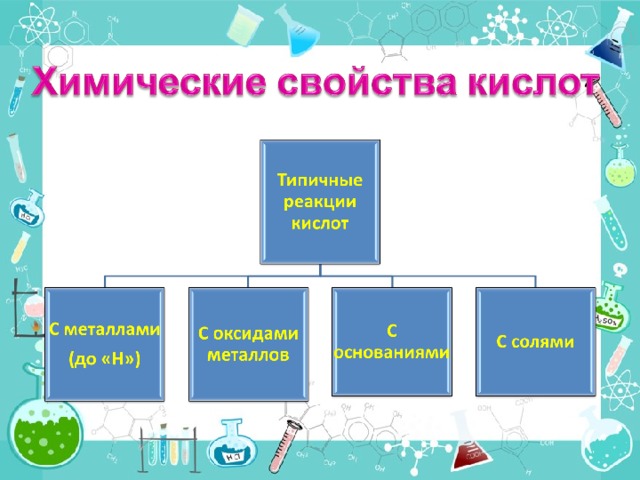
I команда: Возьмите 2 пробирки: одна с кусочками цинка, другая кусочками меди. Добавите к каждому из металлов немного раствора соляной кислоты.
Ответ: Вещество Что наблюдали Уравнения реакций
Zn и HСI Выделился газ Zn + HСI → ZnCI2 + Н2
Cu и HСI Реакции нет
II команда: Возьмите 2 пробирки: одна с оксидом цинка, а другая с оксидом меди. В каждую пробирку прилейте раствор серной кислоты (при необходимости нагреть).
Ответ: Вещество Что наблюдали Уравнения реакций
ZnO и H2SO4 идет бурная реакция ZnО + H2SO4 → ZnSO4 + H2O
CuО и H2SO4 раствор стал голубого цвета CuО + H2SO4 → CuSO4 + H2O
III команда: возьмите 2 пробирки: одна – с гидроксидом натрия (добавьте фенолфталеин), а вторая - с гидроксидом меди (II). (Гидроксид меди (II) предварительно получают взаимодействием сульфата меди (II) и гидроксида натрия). В каждую пробирку добавьте раствор серной кислоты.
Ответ: Вещество Что наблюдали Уравнения реакций
NаOH и HCI раствор обесцветился NаOH + HCI→ NаCI +H2O
фенолфталеин
Cu(OH)2 и H2SO4 Осадок растворился Cu(OH)2 + H2SO4 → CuSO4 + 2 H2O
Учащиеся выполняют задания. По мере выполнения один представитель от команды выходит к доске и заполняет соответствующую таблицу на доске.
Оценивается конкурс по десятибалльной системе.
Учитель: Скажите, пожалуйста, а были ли какие-нибудь неожиданности у команд при выполнении этого задания?
Ответ: Да. Медь не реагирует с серной кислотой.
Вопрос: Почему же такое произошло? Криминалист должен уметь объяснить и такой неожиданный факт.
Учитель: По способности вытеснить водород из кислот металлы можно разделить на две группы и сложить в следующий ряд.
Ребята с учителем работают с рядом активности металлов на стенде и в учебнике на стр. 162.
Учитель: Этот ряд металлов называют вытеснительным рядом металлов или рядом Н.Н. Бекетова – по имени ученого, в XIX веке изучавшего взаимодействие металлов со сложными веществами.
Учитель: Детективное расследование когда-то заканчивается. И детектив, и криминалист должен уметь правильно подготовить документы к сдаче в архив, но для этого необходимо проанализировать собранные материалы и привести их в систему. Мы заканчиваем свое детективное расследование. Следовательно, должны проследить цепочку причин и “последствий поведения” кислот. Приступаем к завершающему этапу нашего отбора в “Криминалисты”. Итак, последний тур.
IV тур: Логическая цепочка.
На данном этапе обучающиеся выполняют упражнения стандартного типа. На доске ряд превращений.
Задание: Напишите уравнения реакций, укажите их тип и назовите полученные вещества: P2O5 → H3PO4→ Na3PO4
Ответ: 1) P2O5 + 3H2O → 2 H3PO4 – реакция соединения
2) 2H3PO4 +3 Na2O → 2Na3PO4 + 3 H2O – реакция обмена
Задание оценивается по 10 бальной системе. Первая команда, выполнившая задание работает у доски.
Подводятся итоги урока, выставляются отметки участникам конкурса с аргументацией поставленных отметок: пояснением активности их работы, правильности ответов и уровня сложности задания.
Домашнее задание: § 38
Учащиеся получают необычное домашнее задание разного уровня сложности “Кем вы считаете себя в химии?”: кандидатом наук, профессором или академиком. Ученые степени расположены в порядке возрастания от кандидата наук до академика. Самая высшая учёная степень – академик. Дома ученики выбирают посильный для себя вариант работы с той учёной степенью, на которую они претендуют. Каждый вариант работы включает 2 задания, одно из них носит творческий характер. К следующему уроку выполняется первое задание, на выполнение второго задания даётся одна неделя.
Кем вы считаете себя в химии?
Кандидатом наук
1. Напишите молекулярное, полное и сокращённое ионное уравнение реакции,
для следующих реакций:
1) гидроксид калия + серная кислота;
2) карбонат калия + азотная кислота;
2. Проведите домашнюю экспериментальную работу по следующему плану:
- капните 1-2 каплями лимонного сока на лакмусовую бумажку;
- отметьте цвет лакмусовой бумажки;
- зарисуйте опыт с лимоном в тетрадь и зафиксируйте результаты опыта;
- сделайте вывод о том, почему лимон кислый?
Профессором
1. Исходя из сокращённых ионных уравнений реакций:
1) 3Ba2+ + 2PO4 3- ---- Ba3(PO4)2 ; 2) Zn2+ + S2- --- ZnS ;
составьте полное ионное и молекулярное уравнения реакций
2. Проведите домашнюю экспериментальную работу по следующему плану:
- опустите лакмусовую бумажку в стакан с лимонадом;
- пронаблюдайте изменение цвета лакмусовой бумажки;
- зарисуйте опыт с лимонадом в тетради и зафиксируйте результаты опыта;
- какое вещество, содержащееся в лимонаде, изменяет окраску индикатора?
Почему? Письменно сделайте вывод ;
- определите формулу этого вещества;
- составьте уравнение электролитической диссоциации данного вещества.
Академиком
1. В приведённых ниже схемах уравнений реакций замените буквы и слова формулами соответствующих веществ. Напишите молекулярные, полные и сокращённые ионные уравнения реакций между этими веществами.
1) С + кислота ---- соль + кислота;
2) Д + кислота ---- соль + вода;
3) А + кислота ---- соль + вода + газ;
2. Используя дополнительную литературу, соберите сведения о распространённости в природе кислот и областях их применения. Придумайте способ представления собранного материала на половине листа. На обратной стороне листа запишите литературу.

 Получите свидетельство
Получите свидетельство Вход
Вход






















 Открытый урок Химические свойства кислот в свете теории электролитической диссоциации (4.21 MB)
Открытый урок Химические свойства кислот в свете теории электролитической диссоциации (4.21 MB)
 0
0 480
480 13
13 Нравится
0
Нравится
0


