КВЕСТ
«Оберегают нас металлы, даря магическую тайну»
(химия 9 класс)
Цель: создать условия для систематизации и обобщения знаний по теме Металлы.
Квест – это командная игра, где команды перемещаются по точкам и выполняют различные задания, только выполнив правильно задание можно двигаться дальше для выполнения следующего задания, процесс интеграции также присутствует в квест – играх. Он представляет собой объединение в единое целое на основе взаимозависимости и взаимодополняемости. Квест, как универсальная игровая технология позволяет за короткое время ненавязчиво вовлечь игроков в разнообразные виды деятельности. Квест - таинственная история.
Этапы работы над квестом
1. Начальный этап (командный)
Участники знакомятся с основными понятиями по теме. Распределяются в команды. Все члены команды должны помогать друг другу.
2. Ролевой этап.
Он предполагает индивидуальную работу в команде на общий результат. Участники выполняют задания. Цель работы не соревновательная, а познавательная. Команда совместно подводит итоги выполнения каждого задания, участники обмениваются материалами для достижения общей цели.
3. Заключительный этап
Команда работает совместно, под руководством педагога, ощущает свою ответственность за результаты работы.
При работе над квестом развивается ряд компетенций:
поиск необходимой информации, оформления результатов работы;
самообучение и самоорганизация;
работа в команде (планирование, распределение функций, взаимопомощь, взаимоконтроль);
умение находить несколько способов решений проблемной ситуации, определять наиболее рациональный вариант, обосновывать свой выбор;
навык публичных выступлений.
Начало квеста:
Люди давно, уже несколько тысяч лет, живут в объятиях «металлургической цивилизации», которая несет и блага, и беды – в зависимости от того, где, как и с какой целью используются её достижения.
Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Перед египтянином, китайцем, древним греком
И каждым современным человеком.
В химическом «городе мастеров» проживают разные металлы, и каждый из них умеет делать что-то полезное людям. Познакомимся для начала с дружной компанией s- элементов. Здесь «трудятся и отдыхают» две дружных семейки – щелочные (литий, натрий, калий, рубидий) и щелочноземельные (кальций, барий, стронций). Среди них есть «цех легких металлов» (бериллий, магний, алюминий и другие), «бригада черной металлургии», в которой, кроме железа, кобальта и никеля, трудятся ещё марганец и хром. В «обществе благородных металлических персон», помимо золота и серебра, мы обнаружим платиновое семейство (рутений, родий, палладий, осмий, иридий и платину). Мощный «профсоюз» у цветных металлов ( медь, олово, цинк, свинец), влиятельное «посольство» представляет интересы редкоземельных металлов – лантаноидов. А ещё – «специалисты по тугоплавким делам» (вольфрам) и «секретная служба по радиоактивности» (уран, радий, полоний). Есть «легионеры», которые могут изменять свойства стали в качестве её добавок (молибден и другие), а также среди металлов есть и необычные, исключительные, замечательные по своей исключительности (цирконий, германий, галлий).
Восстановите «личности» металлов, которые трудятся в химическом «городе мастеров».
(Учащимся выдается текст, в котором названия металлов скрыто; в ходе выполнения (последовательно) различных заданий им необходимо восстановить пропуски в тексте.)
ЛИТИЙ:
Перед вами три чашки с ватными тампонами, подожгите их пожалуйста и определите, в какой чашке находился ватный тампон горящий пламенем красного цвета. На обратной стороне чашки написан № конверта, который нужно взять.
( конверт № 4 – первый житель химического «города мастеров» элемент I группы главной подгруппы второго периода). Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом».
Справка: Литий — щелочной металл, имеющий огромный электрохимический потенциал Так, 1 кг лития может хранить 3 860 ампер-часов. Эта способность лития позволила создать на его основе химические источники тока – аккумуляторы и батареи, используемые для автономного электропитания устройств, Соли лития горят красным цветом.
Далее двигайтесь по стрелке.
Оборудование:(Пропитать ватные тампоны концентрированными растворами солей, окрашивающих пламя, а затем высушить. Тампоны обливают спиртом и поджигают. Получается спиртовое пламя красного цвета (LiCl), зеленого (BaCl2), желтого (NaCl)).
НАТРИЙ:
На столе, в чашках Петри три соли натрия белого цвета: Na2CO3, Na2SO4, NaCl – внесите их в пробирки и добавьте к ним уксусную кислоту; посмотрите на номер чашки Петри с той солью, которая реагирует с кислотой вспениванием и шипением. Возьмите конверт с соответствующим номером и выполните задание.
Роберт Вуд, знаменитый американский физик и великий любитель всяческих проделок, направлялся из лаборатории домой на обед. Дорога шла через негритянский квартал. Была зимняя оттепель, и огромная лужа распростерлась по мостовой между тротуарами, на которых толпились негры, вышедшие погреться на солнышке. Проходя мимо них, Вуд громко закашлял и на виду у всех плюнул в лужу, незаметно бросив в том же направлении кусок вещества величиной с грецкий орех. Прогремел взрыв, полетели искры, большое желтое пламя поднялось над поверхностью воды. Затем раздались вопли, молитвы и один голос громче, чем все остальные, вместе взятые, пробасил: «Спасайся кто может! Этот человек плюнул огнем! На вид он молодой, но только сам старый дьявол умеет это делать!» Какой металл, упомянут в рассказе?
(В конверте лежат карточки с названиями металлов, возьмите нужное название и поместите его в маршрутный лист, в свой «дом».)
Справка: Натрий реакционно-способный и очень активный элемент; при хранении на открытом воздухе он очень легко окисляется с образованием карбоната натрия и гидрата окиси натрия. Он часто используется как теплоноситель, сплав натрия с калием находит применение в атомной энергетике для работы ядерных установок.
Далее двигайтесь по стрелке.
Оборудование: (три пробирки, три пакета с солями, уксусная кислота, чашки Петри, штатив).
КАЛИЙ:
На карточках даны строение атомов элементов ПС, определите какое строение соответствует атому химического элемента I группы главной подгруппы 4 периода.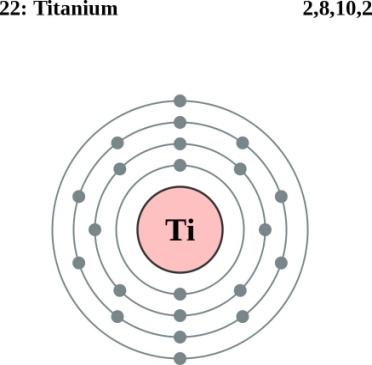
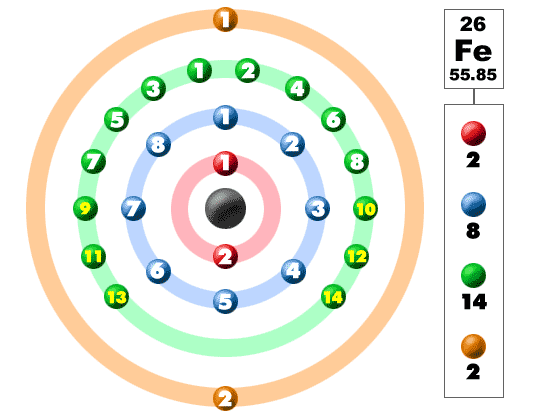
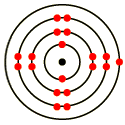
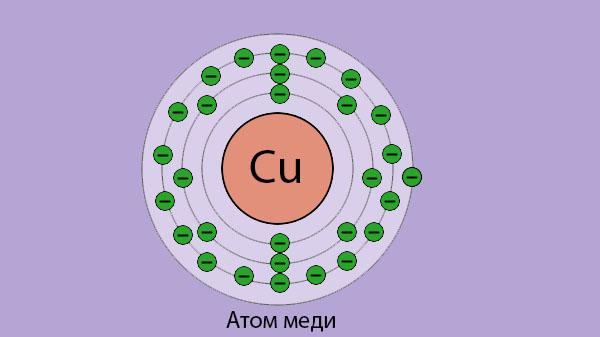
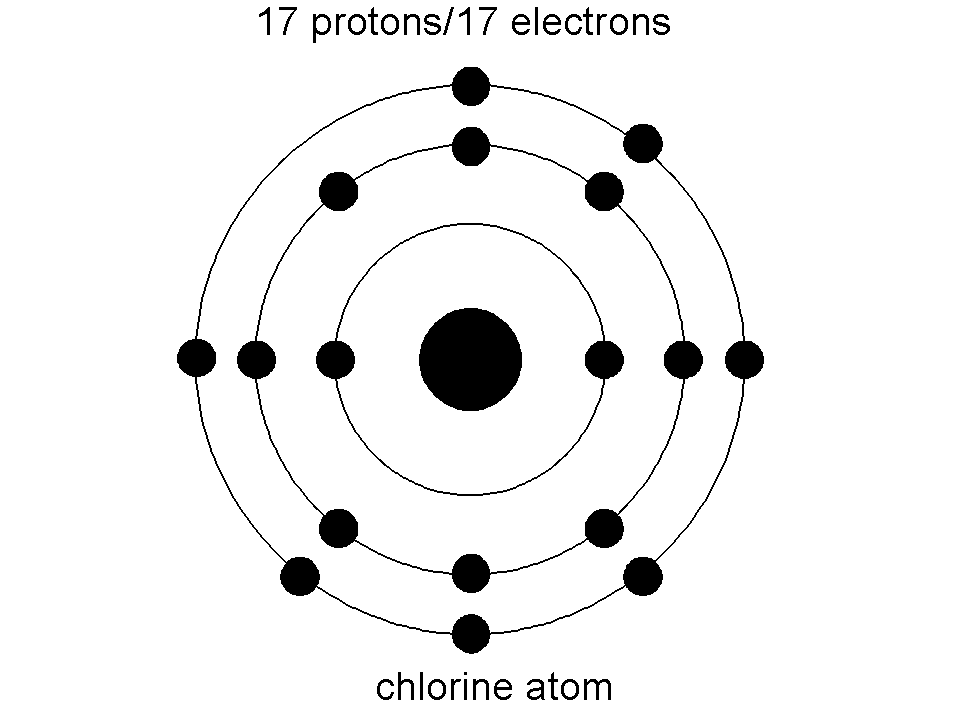


На обратной стороне карточки написан номер конверта, который надо взять (в конверте карточки с названием металлов, возьмите нужный и поместите его на маршрутный лист в свой «дом». Возьмите ключ от замочка и откройте нужный замок).
Справка: В качестве лекарственного средства находит применение иодид калия KI. Иодид калия используют также в фотографии и в качестве микроудобрения. Раствор перманганата калия КMnO4 («марганцовку») используют как антисептическое средство.
Далее двигайтесь по стрелке.
РУБИДИЙ:
Откройте замочек ключиком и заберите карточку с заданием: следующий житель «города мастеров» щелочной металл, у которого в ядре атома находится 48 нейтронов. (в конверте карточки с названием металлов, возьмите нужный и поместите его на маршрутный лист в свой «дом».).
Справка: В организме взрослого человека содержится всего лишь около 1 мг рубидия, который сконцентрирован преимущественно в костях (26,7 мкг/кг), головном мозге (9,8 мкг/кг), легочной ткани (9,2 мкг/кг) и яичниках (20 мкг/кг). Тем не менее, рубидий в небольших концентрациях рассеян по всему организму и содержится во всех мягких тканях, крови и межклеточной жидкости. Поскольку рубидий связывается эритроцитами крови, его концентрация в крови намного выше, чем в межклеточной жидкости. Концентрация рубидия в крови составляет 2,3-2,7 мг/л.
Далее двигайтесь по стрелке.
БАРИЙ:
На столе лежат книги, поставьте книги в алфавитном порядке названий произведений и прочитайте название минерала (поставив книги правильно, на корешках читается слово –барит ). В книге с буквой Б лежит конверт, в котором написано: ваш металл – s-элемент с 56 протонами в ядре. (в конверте карточки с названием металлов, возьмите нужный и поместите его на маршрутный лист в свой «дом».).
Справка: Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2.
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который, в свою очередь, с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Далее двигайтесь по стрелке.
КАЛЬЦИЙ:
Даны уравнения реакции, расставьте в них коэффициенты и определите реакцию обмена.
Ca(OH)2 + CO2 = CaCO3 + H2O
Na + H2O = NaOH + H2
Mg + O2 = MgO
NaNO3 = NaNO2 + O2
CO2 + H2O = H2CO3
Возьмите эту карточку и прочитайте инструкции проведения эксперимента: стакан с малиновым раствором опустите трубочку для коктейля и подуйте в нее до обесцвечивания раствора. Определите, какое вещество выпалов осадок и возьмите конверт с названием этого вещества – карбонат кальция.
(в конверте – следующий житель «города мастеров» металл с относительной атомной массой 40,
в конверте карточки с названием металлов, возьмите нужный и поместите его на маршрутный лист в свой «дом».).
Справка: Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть Дэви получил металл, названный кальцием.
Далее двигайтесь по стрелке.
СТРОНЦИЙ:
Ответьте на вопросы и заполните карточку графического диктанта: (приложив свой ответ к трафарету, получите название металла)



Характеристика химического элемента – магний (если да нет )

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Порядковый номер элемента 12
Относительная атомная масса, округленная до целого, равна 12
Заряд ядра атома равен + 6.
В ядре атома 12 протонов.
В атоме одинаковое количество протонов и электронов.
В атоме 6 электронов.
Относится к элементам- металлам.
Валентность в высшем оксиде II.
В атоме два электронных слоя.
На внешнем слое два электрона.
Заряд ядра атома + 12.
Относится к элементам- неметаллам.
На внешнем слое 4 электрона.
Высший оксид по химическому характеру относится к основным.
Летучего водородного соединения не образует.
Относится к s-элементам.
В ядре атома находится 14 нейтронов.
Атом химического элемента находится в побочной подгруппе.
Атом химического элемента находится в малом периоде.
Атом химического элемента находится в главной подгруппе.
(в конверте с названием, получившегося металла карточки с названием металлов, возьмите нужный и поместите его на маршрутный лист в свой «дом».)
Справка:
Существуют три способа получения металлического стронция:
термическое разложение некоторых соединений;
электролиз;
восстановление оксида или хлорида.
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием. Далее полученный стронций очищается возгонкой.
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется мелкодисперсный стронций, склонный к лёгкому воспламенению.
Далее двигайтесь по стрелке.
БЕРИЛЛИЙ.
Откройте коробочку (там карточка – элемент второй группы главной подгруппы второй группы, второго периода периодической системы химических элементов с 4 электронами, вращающихся вокруг ядра атома. Высокотоксичный элемент. Простое вещество - относительно твёрдый металл светло-серого цвета).
Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом».
Справка: Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твёрдость и прочность сплавов, коррозионную устойчивость поверхностей, изготовленных из этих сплавов изделий. В технике довольно широко распространены бериллиевые бронзы типа BeB (пружинные контакты). Добавка 0,5 % бериллия в сталь позволяет изготовить пружины, которые остаются упругими до температуры красного каления. Эти пружины способны выдерживать миллиарды циклов значительной по величине нагрузки. Кроме того, бериллиевая бронза не искрится при ударе о камень или металл. Один из сплавов носит собственное название рандоль. Благодаря его сходству с золотом рандоль называют «цыганским золотом».
Далее двигайтесь по стрелке.
МАГНИЙ.
Перед вами два конверта, в которых находятся некие металлы, сожгите их в пламени и определите, в каком конверте был магний. Напишите уравнение реакции горения магния и расставьте коэффициенты.2 Mg + O2 = 2MgO, cумма коэффициентов соответствует номеру конверта.
Конверт №5 (Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Соединения магния были известны человеку очень давно. ... В 1808 английский химик и физик Гемфри Дэви при электролизе слегка увлажненной белой магнезии с окисью ртути в качестве катода получил амальгаму нового металла, способного образовывать белую магнезию. Его назвали магнием.
Далее двигайтесь по стрелке.
Оборудование: кусочки магния и железная проволока, спиртовка, пробиркодержатель, спички
АЛЮМИНИЙ.
Перед вами на столе лежат физические тела, определите какое из них, состоит из амфотерного металла 3 группы главной подгруппы 2 периода. Возьмите его и посмотрите на него. Найдите номер на предмете и возьмите конверт.
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Далее двигайтесь по стрелке.
Справка: Этот металл самый распространенный в земной коре, но из руды его выделили только примерно 150 лет назад, и в течение последующих 60 лет он был большой редкостью и ценился дороже золота. В 1854 г. стоимость 1 кг этого металла составляла 1200 рублей (в 270 раз дороже серебра), а в 1899 г. — 1 рубль. Также известно, что у наследника русского царя была погремушка, сделанная из этого металла.
Оборудование: алюминиевая ложка, кость скелета, пакет молока, кусочек мела, гвоздь, проволока, тарелка. На всех предметах стоят номера.
ЖЕЛЕЗО.
Перед вами два металлических цилиндра, определите, какой из цилиндров тяжелее и возьмите его. На каждом из цилиндров написан номер конверта, возьмите нужный вам и прочитайте содержимое конверта. (следующий металл может проявлять степени окисления +2 и +3, он расположен в VIII группе побочной подгруппе периодической системы Д.И. Менделеева, в ядре 26 протонов).
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов.
Далее двигайтесь по стрелке.
КОБАЛЬТ.
Открой коробочку!!! ( химический элемент с атомным номером 27, находится в четвёртом периоде таблицы. Атомная масса элемента 59)
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Кобальт — твёрдый металл, существующий в двух модификациях. При температурах от комнатной до 427 °C устойчива α-модификация. При температурах от 427 °C до температуры плавления (1494 °C) устойчива β-модификация кобальта (решётка кубическая гранецентрированная). Кобальт — ферромагнетик. Желтоватый оттенок ему придаёт тонкий слой оксидов.
Далее двигайтесь по стрелке.
НИКЕЛЬ.
Вам представлены три удивительных факта о химических элементах, с помощью Internet определите какой факт о металле и определите, о каком?
№1.
В поисках философского камня, якобы способного превратить неблагородные металлы в золото, Гамбургский алхимик Г. Бранд в 1669 г. при перегонке сухого остатка от выпаривания мочи впервые получил белый порошок этого вещества. Светоносный элемент принес Бранду немало денег: показывал его богатым людям за вознаграждение.
№2.
Немецких шахтеров в древние времена одолевал дух по имени Никель, мешавший им извлекать медь из руды, очень похожей на медную. Позже, в XVIII веке, научились из этой руды выделять металл. Его назвали именем мифического духа.
№3.
Подземный он не раз вызывал массовое вымирание на планете и постоянно грозил возникновению новой катастрофы в любой момент. Одно из этих событий произошло 245 млн. лет назад в конные Пермского периода, который представлял собой самый трагический случай вымирания фауны в земной хронологии: ископаемые породы свидетельствуют о вымирании тогда около 96% всех морских обитателей. Возможно такой же случай привел к началу вымирания динозавров задолго до катастрофы с падением астероида 65 миллионов лет.
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: В XX веке было установлено, что поджелудочная железа очень богата никелем. При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина и снижать артериальное давление. Избыточное поступление никеля в организм вызывает витилиго. Депонируется никель в поджелудочной и околощитовидной железах.
Далее двигайтесь по стрелке.
МАРГАНЕЦ, ХРОМ.
Соберите пазл «Химические элементы морской воды» и определите металлы, входящие в состав морской воды.
Морская вода содержит в растворенном состоянии всю таблицу Менделеева, присутствуют там уран и золото. Современные технологии позволяют добывать в промышленных масштабах из морской воды всего четыре полезных вещества – пресную воду, поваренную соль и два металла:


(Возьмите карточку с названием элементов, поместите их на маршрутный лист в свой «дом»).
Справка: Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Справка: Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом): {\displaystyle {\mathsf {Fe(CrO_{2})_{2}+4C\rightarrow Fe+2Cr+4CO}}}Феррохром применяют для производства легированных сталей.
Далее двигайтесь по стрелке.
ЗОЛОТО.
разгадайте загадку (написана в зеркальном отражении):
Быть символом не каждому дано,
Но именем моим не без причины
Назвали руки, дождь, тельца, руно,
Сечение и мнений середину.
И в честь меня был назван даже век,
Когда был очень счастлив человек.
Что нынче в имени моем? А встарь
Считали все, что я - металлов царь.
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Природное золото состоит из единственного стабильного изотопа — 197Au. Все остальные изотопы золота радиоактивны, наиболее устойчив из них 195Au (период полураспада — 186 суток).
Далее двигайтесь по стрелке.
СЕРЕБРО.
На столе три пробирки с растворами солей, добавьте в каждую пробирку соляную кислоту и определите результат, пробирка, в которой выпал осадок, напишите уравнение реакции этого процесса, сумма коэффициентов соответствует номеру конверта(4), возьмите его.
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: С этим металлом связано происхождение некоторых слов. В Древней Руси мерой стоимости различных товаров служили бруски этого металла. Если тот или иной предмет стоил дешевле, чем целый брусок, то от бруска отрубали куски соответствующего размера. Отрубленные части именовались рублями. От них и пошло название основной денежной единицы, принятой в нашей стране. Латинское название этого металла носит одно из государств в Южной Америке. Этот металл применяется в фотографии, для получения зеркальных поверхностей.
Далее двигайтесь по стрелке.
Оборудование: AgNO3, BaS, NaSO3 + HCl ; пробирки, штатив.
ПЛАТИНОВОЕ СЕМЕЙСТВО: сыграйте в лото – формула = название (найдите металлы)
| Пиролюзит | Мрамор | Малахит | Пищевая сода | Кальцинированная сода | Силикат-глыба | Глауберова соль | Ляпис | Роговое серебро |
| MnO2 Р | CaCO3 У | Cu2(OH)2CO3 Т | NaHCO3 Е | Na2CO3 Н | Na2SiO3 И | Na2SO4 ∙ 10 H2O Й | AgNO3 Р | AgCl О |
| Плавиковый шпат | Криолит | Барит | Витерит | Пирит | Бертолетова соль | Глина | Сурик | Боксит |
| CaF Д | Na3[AlF6] И | BaSO4 Й | BaCO3 П | FeS2 А | KClO3 Л | PbO Л | Pb3O4 А | Al2O3 ∙ nH2O Д |
| Сулема | Чилийская селитра | Калийная селитра | Гематит | Магнетит | Железный купорос | Марганцевый купорос | Каустик | Желтая кровяная соль | Красная кровяная соль |
| HgCl2 И | NaNO3 Й | KNO3 О | Fe2O3 С | FeO∙Fe2O3 М | FeSO4∙7H2O И | MnSO4∙4H2O Й | NaOH И | K4[Fe(CN)6] Р | K3[Fe(CN)6] И |
| Поташ | Гашеная известь | Пушонка | Гипс | Преципитат | Двойной суперфосфат | Эпсомит | Сильвинит | Галит | Корунд |
| K2CO3 Д | Ca(OH)2 И | CaO Й | CaSO4∙2H2O П | CaHPO4∙2H2O Л | Ca(H2PO4)2 А | MgSO4∙7H2O Т | NaCl∙KCl И | NaCl Н | Al2O3 А |
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Открыт профессором Казанского университета Карлом Клаусом в 1844 году, в том же году опубликовавшим о новом элементе большую статью «Химические исследования остатков Уральской платиновой руды и металла рутения» в «Учёных записках Казанского университета». Об открытии, методе получения и свойствах нового элемента Клаус сообщил в письме Г. И. Гессу на немецком языке, который зачитал его на заседании Петербургской Академии наук 13 сентября 1844 года, этот текст был опубликован в бюллетене Академии и в переводе на русский язык — в «Горном журнале». Клаус выделил рутений из уральской платиновой руды в чистом виде и указал на сходство между триадами рутений — родий — палладий и осмий — иридий — платина.
Далее двигайтесь по стрелке.
МЕДЬ.
Перед вами три пробирки с веществами: соляная кислота, гидроксид натрия и хлорид алюминия; добавьте в каждую пробирку CuSO4 . В той пробирке, в которой выпал синий осадок, возьмите карточку с уравнением реакции данного процесса. Определите вещество, которое выпало в осадок и возьмите конверт с номером степени окисления металла, входящего в состав данного вещества: Cu(OH)2, CuCl2 , Al2 (SO4)3 .(вещества написаны на карточках).
На карточки с нужным веществом написано задание: выберите конверт, на котором написана соответствующая реакция процесса:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
CuSO4 + 2HCl = CuCl2 + H2SO4
3CuSO4 +2 AlCl3 = 3CuCl2 + Al2(SO4)3
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришел на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали.
Далее двигайтесь по стрелке.
ОЛОВО.
Перед вами полоски цветной бумаги, соберите их в правильном порядке и узнайте информацию про некий металл.
При комнатной температуре это серебристо-белый металл, но при опускании температуры до 13,2 °C и ниже начинается его переход в другое фазовое состояние — так называемое серое в виде порошка. Соприкосновение серого и белого ускоряет процесс перекристаллизации последнего, поэтому данный процесс именуют « чумой». Она стала одной из причин гибели экспедиции Скотта к Южному полюсу, потому что хранившееся в запаянных баках ИЗ ЭТОГО МЕТАЛЛА топливо просочилось наружу. Есть также мнение, что она способствовала поражению армии Наполеона в России, так как в сильные морозы раскрошились пуговицы на мундирах солдат. Что это за металл?
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев.
Далее двигайтесь по стрелке.
ЦИНК.
Таблица продуктов, содержащих этот металл в большом количестве
| Наименование продукта | Содержание |
| Устрицы | 60 |
| Пшеничные отруби | 16 |
| Шоколад темный | 10 |
| Говяжья печень | 8,4 |
| Кунжутное семя | 7,8 |
| Тыквенные семечки | 7,5 |
| Куриные сердечки | 7,3 |
| Куриная печень | 6,6 |
| Свиная печень | 5,9 |
| Семена подсолнечника | 5,6 |
| Льняное семя | 5,5 |
| Язык отварной | 4,8 |
| Куриные грудки | 4,5 |
| Имбирь | 4,7 |
| Орехи кедровые | 4,3 |
| Яичные желтки | 3,9 |
| Баранина | 3,5 |
| Сыр твердый | 3,5 |
| Чечевица | 3,8 |
| Арахис | 3,3 |
| Говяжье мясо | 3,2 |
| Горох | 3,2 |
| Фасоль | 3,2 |
| Свинина | 3,0 |
| Гречка | 2,8 |
| Орехи грецкие | 2,7 |
| Овсяная крупа | 2,7 |
| Ячневая крупа | 2,7 |
| Мясо индейки | 2,45 |
| Фундук | 2,4 |
| Миндаль | 2,2 |
| Кешью | 2,1 |
| Фисташки | 1,4 |
| Грибы белые свежие | 1,4 |
Определите, что это за металл?
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Далее двигайтесь по стрелке.
СВИНЕЦ.
На карточках последовательно соедините линии, у вас получится рисунок.
№1 основные металлы I и II группа (по возрастанию атомных масс)
№2 амфотерные металлы
№3 металлы 4 периода
№5 металлы 6 периода
Сопоставьте получившиеся рисунки с оригиналами. На каждом оригинале написана цифра. Найдите разность между количеством букв в названии химической посуды и цифрой на оригинале. Эта цифра соответствует порядковому номеру химического элемента. Возьмите конверт, на котором стоит знак химического элемента под номером 4 (бериллий).
![]()
1
![]()
2
![]()
3
![]()
4
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Этот металл входит в состав типографского сплава, его оксид используют как добавку при производстве хрустального стекла, главные потребители этого металла — аккумуляторная и кабельная промышленность. Кроме того, его используют для защиты от рентгеновского излучения.
Далее двигайтесь по стрелке.
ЛАНТАНОИДЫ.
Перед вами венгерский кроссворд, решите его и из оставшихся букв сложите название группы элементов.
| М | Е | Д | Ь | Х | Т | Ж | Д |
| Л | Ц | И | Н | Р | И | Е | Й |
| С | Е | Н | З | О | Т | Л | И |
| Р | Р | К | О | М | А | Е | Д |
| Т | Е | А | Л | Т | Н | З | А |
| У | Б | К | О | А | Ы | О | Н |
| Т | Р | А | Т | О | Н | В | А |
| Ь | О | Д | М | И | Й | О | И |
(вычеркните название амфотерных металлов и из оставшихся букв сложите слово)
Номер группы родоначальника этих элементов соответствует номеру конверта.
(Возьмите карточку с названием группы элементов, поместите его на маршрутный лист в свой «дом»).
Справка: семейство, состоящее из 15 химических элементов группы 6-го периода периодической таблицы — металлов, с атомными номерами 57—71 (от лантана до лютеция). Все представители семейства имеют стабильные изотопы, кроме прометия.
Далее двигайтесь по стрелке.
ВОЛЬФРАМ.
Перед вами закодированный текст. С помощью кода прочитайте его и определите следующего жителя химического «города мастеров»
Ѿ Ϣ ʤ Ϣ Ʊ Č Ϣ Ö Ƣ Ƣ Ȝ Ö Љ ʤ Ā€ Ϣ Ξ Ԋ Ü Џ Č Ξ Ϣ ʤ Œ Ø Ϋ Ϯ Ψ Ψ Č Ψ ʤ Ñ ʤ Ϡ Ȝ ʤ Œ Ψ ʤ Ā Ø Ϋ Ϯ Ψ Ψ Č Ü Џ Č Ξ Ϣ ʤ Ʊ Ñ ʤ Ƣ Ͽ Џ ʤ Ʊ Ψ Č Ϋ€ ʤ Ā Č€ Ξ Ψ ʤ Ƣ Ͽ Ɲ Ϯ Č Ϣ Ξ Ԋ Ü ʤ Ξ Ü Č Ϣ € Ϣ Č Ƣ Ͽ Ȝ Ԝ Љ Ψ Ϋ€ Ñ ʤ Ϋ Ö Љ Ʃ Ö Ʃ Ȝ€ Ϣ Ͽ Ȝ Ö Ʃ Ö Ƣ€ Ü Ö Ȝ€ Ԋ
| А | Б | В | Г | Д | Е | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | |
| Ö | Ñ | Ü | Ø | Ā | Č | Ɣ | Ɲ | € | Œ | Ʃ | Ƣ | Ʊ | Ȝ | ʤ | Ψ | Ϋ | Ξ | Ϣ | Ϯ | |
|
|
| |||||||||||||||||||
| Ф | Х | Ч | Ц | Ь | Ъ | Ш | Щ | Э | Ю | Я | Ы |
|
|
|
|
|
|
|
| |
| Ϧ | Љ | Ϡ | Ϙ | Ͽ | Ͼ | Џ | Ѭ | Ѿ | Ҁ | Ԋ | Ԝ |
|
|
|
|
|
|
|
| |
(Этот металл находится в шестой группе побочной подгруппе, в шестом большом периоде, используется в осветительных приборах как нить накаливания.)
(Возьмите карточку с названием элемента, поместите его на маршрутный лист в свой «дом»).
Справка: Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Далее двигайтесь по стрелке.
УРАН, РАДИЙ, ПОЛОНИЙ.
РАЗГАДАЙТЕ РЕБУСЫ и определите металлы



(Возьмите карточку с названием элементов, поместите их на маршрутный лист в свой «дом»).
Справка: Россия по запасам урана, с учетом резервных месторождений, занимает 3-е место в мире (после Австралии и Казахстана). В месторождениях России содержится почти 550 тысяч тонн запасов урана, или немногим менее 10% его мировых запасов; около 63 % их сосредоточено в Республике Саха (Якутия). Основными месторождениями урана в России являются: Стрельцовское, Октябрьское, Антей, Мало-Тулукуевское, Аргунское молибден-урановые в вулканитах (Забайкальский край), Далматовское урановое в песчаниках (Курганская область), Хиагдинское урановое в песчаниках (Республика Бурятия), Южное золото-урановое в метасоматитах и Северное урановое в метасоматитах (Республика Якутия). Кроме того, выявлено и оценено множество более мелких урановых месторождений и рудопроявлений.
Справка: В России радий впервые был получен в экспериментах известного советского радиохимика В. Г. Хлопина.
В 1918 году на базе Государственного рентгеновского института было организовано Радиевое отделение.
Это отделение в 1922 году получило статус отдельного научного института.
Одной из задач Радиевого института были исследования радиоактивных элементов, в первую очередь — радия.
Справка: Полоний - первый элемент, вписанный в таблицу Менделеева после открытия радиоактивности. Полоний был открыт известными химиками Пьером и Марией Склодовской-Кюри в 1898 (по другим данным - в 1897) году. Элемент получил свое название от Польши - родины Марии (от латинского Polonia - Польша). Мария Склодовская -Кюри получила за это открытие Нобелевскую премию.
Далее двигайтесь по стрелке.
МОЛИБДЕН.
Где же мистер Вольт?
Этой осенью имя скромного учителя химии местной школы Дана Вольта попало во все газеты. Он открыл недорогой способ превращения воды в бензин и пребывал с тех пор в прекрасном настроении. Еще бы! С помощью этого открытия он мог заработать миллионы долларов.
Но сегодня его имя попало в газеты совсем по другому поводу. Дан Вольт был похищен!
Вот уже несколько часов доктор Квик, его сын Джуниор и лейтенант Кейли находились в доме Вольта и беседовали с безутешной миссис Вольт. Доктор Квик и Джуниор отправились сюда прямо с футбола.
- Я была просто в шоке, когда обнаружила вот это послание, - рыдала миссис Вольт.
Лейтенант Кейли прочел записку:
- «Свобода в обмен на формулу! И не пытайтесь нас разыскивать!»
- Когда я утром отправилась за покупками, он еще был дома, - сказала миссис Вольт. – выезжая за ворота, я встретила нашего соседа Бобби Халла. Он подъезжал к дому на грузовике, и в кабине еще кто – то был.
Доктор Квик прошел на кухню. На столе стояла бутылка лимонного сока и стакан с какой-то жидкостью, похожей на лимонад. Если там и был лед, то он растаял. В вазе лежали бананы, виноград и яблоки.
Рядом – листок бумаги и зубочистка. На подоконнике он заметил пепельницу, полную окурков.
- Ваш муж курит? – спросил доктор Квик.
- Нет, он никогда не курил, - ответила миссис Вольт.
- Думаю, если мы найдем утюг, то сможем найти и мистера Вольта, - внезапно произнес Джуниор.
- Пожалуй, ты прав, сынок, - улыбнулся сыщик.
Что имел в виду Джуниор?
Прочитайте тайное послание: - конверт № 2 (в конверте: металл, имеющий электронную конфигурацию внешнего слоя: 4d55s1)
(Возьмите карточку с названием элементов, поместите их на маршрутный лист в свой «дом»).
Справка: При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400 °C. Выше 600 °C быстро окисляется до триоксида МоО3. Этот оксид получают также окислением дисульфида молибдена MoS2 и термолизом молибдата аммония (NH4)6Mo7O24·4H2O.
Мо образует оксид молибдена (IV) МоО2 и ряд оксидов, промежуточных между МоО3 и МоО2.
Далее двигайтесь по стрелке.
Оборудование: лист с тайным посланием – «конверт №2», свеча, спички
ЦИРКОНИЙ, ГЕРМАНИЙ.
Добавьте к названию города Ман в Кот-Дивуаре Юго-Западной Африки 3 буквы в начале слова и две – в конце так, чтобы получилось название химического элемента, который открыт немецким химиком К Винклером в 1886 г. Этот элемент Д. И. Менделеев назвал экасилицием. (Германий)
Добавьте к названию вида искусства 4 буквы в конце слова, и вы получите название химического элемента IV группы периодической системы химических элементов Д. И. Менделеева (цирк). (Цирконий)
Номер конверта соответствует количеству электронов на последнем уровне атома германия -4.
(Возьмите карточку с названием элементов, поместите их на маршрутный лист в свой «дом»).
Справка: Циркон является самым распространенным циркониевым минералом. Он встречается во всех типах пород, но главным образом в гранитах и сиенитах. В графстве Гиндерсон (штат Северная Каролина) в пегматитах были найдены кристаллы циркона длиной в несколько сантиметров, а на Мадагаскаре были обнаружены кристаллы, вес которых исчисляется килограммами.
Справка: Первоначально Винклер хотел назвать новый элемент «нептунием», но это название было дано одному из предполагаемых элементов, поэтому элемент получил название в честь родины учёного — Германии.
Далее двигайтесь по стрелке.
ГАЛЛИЙ.
Надутые шарики с буквами внутри, подвешены к сетке. С помощью дротика нужно лопнуть шары, бросая дротик с расстояния 2м. Из букв сложит название слово, оно соответствует названию сплава меди, возьмите соответствующий конверт и откройте дверь- на столе картинки, которые подскажут название следующего металла (галлы – астерикс, обелиск…) металл- галлий.
(Возьмите карточку с названием элементов, поместите их на маршрутный лист в свой «дом»).
Справка: Существование галлия было научно предсказано Д. И. Менделеевым. При создании периодической системы химических элементов в 1869 г. он, основываясь на открытом им Периодическом законе, оставил вакантные места в третьей группе для неизвестных элементов — аналогов алюминия и кремния (экаалюминий и экасилиций). Менделеев, основываясь на свойствах соседних, хорошо изученных элементов, достаточно точно описал не только важнейшие физические и химические свойства, но и метод открытия — спектроскопия.
На маршрутном листе прикрепить все металлы в соответствующие «дома».
На выходе из класса, на двери таблица с заданиями: нужно взять буквы только щелочных металлов и сложить слово – конверт с соответствующим словом даст ключ от дверей.
| № | Справка о металлах | Металл |
| 1. | Существование этого металла было научно предсказано Д. И. Менделеевым. При создании периодической системы химических элементов в 1869 г. он, основываясь на открытом им Периодическом законе, оставил вакантные места в третьей группе для неизвестных элементов — аналогов алюминия и кремния (экаалюминий и экасилиций). Менделеев, основываясь на свойствах соседних, хорошо изученных элементов, достаточно точно описал не только важнейшие физические и химические свойства, но и метод открытия — спектроскопия |
Ga
(М) |
| 2. | Щелочной металл, имеющий огромный электрохимический потенциал Так, 1 кг этого металла может хранить 3 860 ампер-часов. Эта способность его позволила создать на его основе химические источники тока – аккумуляторы и батареи, используемые для автономного электропитания устройств, Соли этого металла горят красным цветом. |
Li
(В) |
| 3. | Первоначально Винклер хотел назвать новый элемент «нептунием», но это название было дано одному из предполагаемых элементов, поэтому элемент получил название в честь родины учёного — Германии | Ge
(О) |
| 4. | В организме взрослого человека содержится всего лишь около 1 мг этого металла, который сконцентрирован преимущественно в костях (26,7 мкг/кг), головном мозге (9,8 мкг/кг), легочной ткани (9,2 мкг/кг) и яичниках (20 мкг/кг). Тем не менее, в небольших концентрациях рассеян по всему организму и содержится во всех мягких тканях, крови и межклеточной жидкости. Поскольку он связывается эритроцитами крови, его концентрация в крови намного выше, чем в межклеточной жидкости. Концентрация в крови составляет 2,3-2,7 мг/л. |
Rb (O) |
| 5. | Сплав её с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век. |
Cu (Ш) |
| 6. | Этот металл реакционно-способный и очень активный элемент; при хранении на открытом воздухе он очень легко окисляется с образованием карбоната и гидрата окиси. Он часто используется как теплоноситель, сплав его с калием находит применение в атомной энергетике для работы ядерных установок.
|
Na (Д) |
| 7. | С этим металлом связано происхождение некоторых слов. В Древней Руси мерой стоимости различных товаров служили бруски этого металла. Если тот или иной предмет стоил дешевле, чем целый брусок, то от бруска отрубали куски соответствующего размера. Отрубленные части именовались рублями. От них и пошло название основной денежной единицы, принятой в нашей стране. Латинское название этого металла носит одно из государств в Южной Америке. Этот металл применяется в фотографии, для получения зеркальных поверхностей. |
Ag (K) |
| 8. | Добавка 0,5 % этого металла в сталь позволяет изготовить пружины, которые остаются упругими до температуры красного каления. Эти пружины способны выдерживать миллиарды циклов значительной по величине нагрузки. Один из сплавов носит собственное название рандоль. Благодаря его сходству с золотом рандоль называют «цыганским золотом». |
Be
(Ю) |
| 9. | В качестве лекарственного средства находит применение иодид этого металла. Иодид используют также в фотографии и в качестве микроудобрения. Раствор перманганата («марганцовку») используют как антисептическое средство.
|
K
(А) |
| 10. | В XX веке было установлено, что поджелудочная железа очень богата этим металлом. При введении вслед за инсулином его продлевается действие инсулина и тем самым повышается гипогликемическая активность. Он оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Может угнетать действие адреналина и снижать артериальное давление. Избыточное поступление его в организм вызывает витилиго. Депонируется в поджелудочной и околощитовидной железах. |
Ni (Ы) |
Слово - ВОДА
Литература:
Источник: http://irinazaytseva.ru/cink-v-produktax-pitaniya.html

 Получите свидетельство
Получите свидетельство Вход
Вход












 Образовательный квест по химии 9 класс "Оберегают нас металлы...." (1.06 MB)
Образовательный квест по химии 9 класс "Оберегают нас металлы...." (1.06 MB)
 0
0 1603
1603 98
98 Нравится
0
Нравится
0


