«Методика обучения учащихся решению расчетных задач на выведение молекулярных формул органических веществ»
Автора работы:
учитель
МБОУ
«Средняя школа №4 им. Дважды Героя
Советского Союза А. О. Шабалина»
Некрасова Светлана Марьяновна,
Архангельская область, г. Онега
Введение.
Недостаточно просто выучить теоретический материал по разным разделам химии, необходимо выстроить определенный алгоритм для самостоятельной подготовки к выпускному экзамену, выявить самые сложные задания, чтобы уделить им максимальное количество времени.
Химия является экспериментальной наукой, которую невозможно представить без ярких и запоминающихся химических экспериментов. Но как правильно использовать их результаты при выполнении тестовых заданий? Можно ли разработать алгоритм для решения задач на вывод формул органических веществ? Сколькими способами можно решить одну и ту же задачу? Попробуем вместе проанализировать все новшества, введенные в единый государственный экзамен по химии в текущем учебном году, проанализировать итоги ЕГЭ по Архангельской области за 2017 год, а также подобрать оптимальный механизм подготовки к ЕГЭ.
Цель работы: анализ основных ошибок и поиск оптимальных способов решения задач ЕГЭ на вывод формул органических веществ.
Задачи работы:
проанализировать основные изменения в структуре и заданиях ЕГЭ по химии на текущий учебный год;
выявить наиболее сложные расчетные задания по органической химии;
рассмотреть различные способы решения задач на вывод формул органических веществ;
провести эксперимент, подтверждающий правильность решения задачи;
предложить старшеклассникам алгоритм подготовки к ЕГЭ по химии
Методы проведения работы:
работа с литературными источниками;
проведение экспериментов;
статистическая обработка результатов
Объект исследования: задачи ЕГЭ по органической химии.
Предмет исследования: способы решения расчетных и экспериментальных задач по органической химии.
Гипотеза эксперимента: создав определенный алгоритм действий, можно успешно подготовиться к сдаче выпускного экзамена по химии.
Основная часть.
Для начала попробуем выяснить, в чем состоит максимальная сложность ЕГЭ по химии. В этом году структура экзамена была изменена, и в варианте 2017 года нет вопросов, которые бы предполагали выбор однозначного ответа. Вопросы сформулированы так, чтобы выпускник давал не меньше двух ответов, поэтому сдать экзамен путем «постановки галочки» уже не удастся. [3]
В выпускном тесте оставлено 34 задания, причем только пять из них представлено во второй части, его сложность возросла. Познакомившись с результатами сдачи ЕГЭ по химии в Архангельской области в прошлом учебном году (Приложение 1), я пришла к выводу, что достаточное количество ошибок сделано ребятами в решении задач на вывод формул органических веществ, а также в цепочках превращений. В рамках одной исследовательской работы сложно проанализировать сразу все ошибки, допускаемые выпускниками. Остановимся на тех проблемах, которые связаны с вычислениями, так как и для меня, эти задания изначально показались сложными.
Основа для анализа.
В методическом отчете, составленном под руководством старшего эксперта региональной предметной комиссии по химии Таскаевой Л. Г., подробно изложены основные ошибки, допускаемые участниками ЕГЭ в Архангельской области (ГАУ АО ЦОКО). В прошлом учебном году ЕГЭ по химии сдавало 5895 человек, причем наблюдается тенденция незначительного снижения общего количества участников ЕГЭ.
Таблица 1
| химия | 2015 | 2016 | 2017 | |||
| чел. | % от общего числа участников | чел. | % от общего числа участников | чел. | % от общего числа участников | |
| 669 | 10 | 675 | 10,7 | 624 | 10,6 | |
В Онежском районе в 2017 году всего 10 человек выбрало химию для сдачи в форме ЕГЭ, это составляет 0,17 % от общего количества участников ЕГЭ в регионе. В основном химию сдают девушки (7,74 % от общего числа).
2.2 Особенности КИМ по химии.
КИМ осуществляют проверку 56 элементов содержания, причем 42 элемента связаны с базовым уровнем химии. Они представляют суммарную систему знаний о веществах, их составе, строении и основных свойствах, о химической реакции, сущности и закономерностях протекания реакций разного типа, практическом применении веществ, методах познания химических объектов. (Приложение 1). Такие задания составляют больше половины от общего числа вопросов, а на расчеты по химическим формулам и уравнениям реакций» приходится 35% от всех заданий.
В спецификации 2017 года изменения коснулись первой части работы, она содержит 29 заданий с кратким ответом. Из них 20 заданий базового уровня сложности и 9 заданий повышенного уровня сложности. Сначала предлагаются задания базового уровня сложности, затем - повышенного; потом снова – базового и повышенного.
Тип и сложность каждого задания определяется в полном соответствии с уровнем изучения проверяемого элемента содержания и необходимым уровнем его усвоения, а так же в соответствии с видом учебной деятельности, которую необходимо осуществить при выполнении этого задания.
Задания отличаются не только по формулировкам условия, но и по формам предъявления результатов ответа, поэтому есть серьезное отличие в логике поиска правильного ответа. Подобное построение заданий способствует проверке метапредметных связей, умения самостоятельно оценивать правильность выполнения учебной и учебно-практической задачи.
Мы остановимся на заданиях второго уровня сложности, предполагающих развернутый ответ. Такие задания направлены на проверку уровня усвоения важнейших элементов содержания; знаний о взаимосвязях веществ различных классов; расчетные задачи [2]. Они ориентированы на проверку умений объяснять обусловленность свойств и применения веществ их составом и строением, характер взаимного влияния атомов в молекулах неорганических и органических веществ, сущность и закономерности протекания изученных типов реакций, проводить комбинированные расчеты по химическим уравнениям.
Комбинирование осуществляется таким образом, чтобы уже в их условии прослеживалась необходимость последовательного выполнения нескольких взаимосвязанных действий, выявления причинно-следственных связей между элементами содержания, формулирования ответа в определенной логике и с аргументацией отдельных положений.
Задания № 35 в работе 2018 года включают те же элементы содержания, но отличаются по уровню сложности и требуют другого алгоритма решения. По шкале оценивания за расчетную задачу можно получить 4 балла, что является достаточным основанием для изучения способов выполнения задач такого типа [2].
В нашем образовательном учреждении нет профильных классов, дополнительных элективных курсов по химии, поэтому вся нагрузка по подготовке к ЕГЭ по химии ложится на плечи педагога.
2.3 Анализ результатов выполнения расчетных заданий.
Согласно информации, представленной Л, Н. Таскаевой в своем отчете, всего 8,3 % от общего числа выпускников, сдававших ЕГЭ по химии в Архангельской области, справились с задачей по нахождению молекулярной формулы органического вещества. Это является прямым подтверждением того, что у старшеклассников недостаточно сформированы навыки проведения расчетов, нет систематизации информации о качественных свойствах различных классов веществ. Причина в минимальном количестве часов, выделяемых на формирование подобных навыков и умений на базовом уровне.
Учащиеся испытывают серьезные затруднения при записи условия задачи, составлении уравнения, проведении математических расчетов.
Задачи на выведение молекулярных формул органических веществ (задание № 34) полностью решили и 11% в 2016 году и 8% в 2017 году. Это является прямым подтверждением актуальности нашей работы, ее своевременности и значимости.
3. Практическая часть.
Учитывая, что такие расчетные задачи систематически вызывают трудности у многих учеников Архангельской области (в нашем ОУ в 2015-2016 году ЕГЭ по химии ребята не сдавали), попробуем составить алгоритм действий, чтобы он был доступен и ребятам, изучающим предмет на базовом уровне. Для этого сначала рассмотрим варианты решения шести расчетных задач (№34 ЕГЭ) двумя способами [4].
Условия и решения задач №34 ЕГЭ по химии.
Задача 1.
При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта. На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
Дано. Найти. Формулы.
m (CxHyOz)= 17,5 г (СxHy) или CxHyOz m=М*n
СxHy √ = √ m*n
V CO2= 28 л √ = m/ρ
V H2O=22,5 мл
ρ =3,125 г/л
Первый способ решения задачи.
Определяем количество (в молях) продуктов реакции через молярный объем.
nCO2= 28л /22,4 л/моль = 1,25 моль
2. Определяем количественное содержание элемента (углерода) в продукте реакции.
nC=nCO2=1,25 моль
3. Определяем массу элемента.
mC=1,25 моль*12г/моль=15 г.
Определяем массу воды, зная, что ее ρ= 1г/мл
mH2O=22,5 г/мл*1г/мл=22,5 г
Находим количество продукта реакции (водяного пара).
n H2O =22,5 г/18г/моль =1,25 моль
6. Определяем количественное содержание элемента (водорода) в продукте реакции.
nH=2n H2O=2,5моль
7. Определяем массу элемента.
mH=2,5моль*1 г/моль=2,5 г
8. Суммируем массы элементов, чтобы определить наличие (отсутствие) в молекуле атомов кислорода.
mC+mH=15г +2,5 г = 17,5 г
Это соответствует данным задачи, следовательно, в искомом органическом веществе нет атомов кислорода.
9. Находим количественное отношение:
nC: nH=1,25:2,5=1: 2
CH2 – простейшая формула
10. Определяем молярную массу искомого вещества, используя плотность.
M в=3,127 г/л *22,4 л/моль = 70 г/моль
n=5, следовательно, молекулярная формула вещества имеет вид: С5H10
По условию задачи сказано, что получают вещество путем дегидратации спирта, следовательно, оно является алкеном.
CH3 CH3
/ H2SO4 /
CH3-C-CH2-CH3 = CH3-C=CH-CH3+H2O
/
OH
Второй способ решения задачи.
1. Зная, что данное вещество получают путем дегидратации спиртов, делаем вывод о его возможной принадлежности к классу алкенов. Общая формула- СnН2n
2. Определяем молярную массу искомого вещества, используя плотность.
M в=3,127 г/л *22, 4 л/моль = 70 г/моль
3. Определяем молярную массу вещества через сумму относительных атомных масс.
M в=12n+2n
4. Определяем число атомов углерода в молекуле этиленового углеводорода.
14 n=70, n=5, следовательно, молекулярная формула вещества имеет вид: С5H10
По условию задачи сказано, что получают вещество путем дегидратации третичного спирта, следовательно, оно является алкеном.
CH3 CH3
/ H2SO4 /
CH3-C-CH2-CH3 = CH3-C=CH-CH3+H2O
/
OH
Вывод. Второй способ решения задачи возможен только в том случае, если обучающийся знает способы получения органических веществ, их химические свойства.
Задача 2.
При полном сгорании 22,5 г а - аминокарбоновой кислоты в кислороде собрано 13,44 л (н.у.) углекислого газа и 3,36 л (н.у.) азота. Выведите формулу этой кислоты.
Дано. Найти. Формулы.
m(RCHNH2COOH) =22,5 г RCHNH2COOH m=М*n
√ (CO2) =13,44 л √ = √ m*n
√ (N2) =3,36 л
√ m=22,4 л/моль
Первый способ решения задачи.
Определяем количество (в молях) продуктов реакции через молярный объем.
n(N2) =√/√ m=3,36 л/22,4 л/моль=0,15 моль
Составляем уравнение реакции (используем общую формулу аминокарбоновой кислоты). По уравнению, зная количество вещества (в молях) выделяющегося азота, определяем количество взятой аминокарбоновой кислоты (в молях).
x моль 0,15 моль
2RCHNH2COOH+ аО2= вCO2+ N2+ dH2O
2 моль 1 моль
x=0, 15*2/1=0, 3 моль
По формуле определяем молярную массу аминокарбоновой кислоты.
М(RCHNH2COOH) = m/n=22,5 г/0, 3 моль=75 г/моль
Определяем молярную массу аминокарбоновой кислоты через относительные атомные массы элементов.
М(RCHNH2COOH) =(R+74) г/моль
Приравниваем значения молярных масс, решаем уравнение и определяем значение радикала.
R+74=75, R=75-74=1
Методом подбора определяем радикал и составляем формулу искомой аминокарбоновой кислоты, записываем ответ в задаче.
Следовательно, R=H, получаем формулу CH2NH2COOH (глицин)
Ответ: CH2NH2COOH
Второй способ решения задачи.
Определяем количество (в молях) продуктов реакции через молярный объем.
n(CO2) =√/√ m=13,44л/22,4 л/моль=0,6 моль
Составляем уравнение реакции (используем общую формулу аминокарбоновой кислоты). По уравнению, зная количество вещества (в молях) выделяющегося азота, определяем количество взятой аминокарбоновой кислоты (в молях).
x моль 0,6 моль
2RCHNH2COOH+ аО2= вCO2+ N2+ dH2O
2 моль в моль
x=0, 6*2/в=1, 2 /в моль
По формуле определяем молярную массу аминокарбоновой кислоты.
М(RCHNH2COOH) = m/n=22,5 в г/1, 2 моль=75 в г/моль
Определяем молярную массу аминокарбоновой кислоты через относительные атомные массы элементов.
М(RCHNH2COOH) =(R+74) г/моль
Приравниваем значения молярных масс, решаем уравнение и определяем значение радикала.
R+74=75в, R=75в-74=1 (примем в=1)
Методом подбора определяем радикал и составляем формулу искомой аминокарбоновой кислоты, записываем ответ в задаче.
Следовательно, R=H, получаем формулу CH2NH2COOH (глицин)
Ответ: CH2NH2COOH
Вывод. Второй способ решения задачи возможен только в том случае, если обучающийся владеет элементарными математическими навыками.
Задача 3.
Некоторое органическое вещество, взаимодействуя с гидроксидом натрия, образует продукт, содержащий 33,82% металла (по массе). Известно, что это вещество может реагировать с этанолом и оксидом серебра (I), а также окрашивает метилоранж в розовый цвет. На основании этих данных:
1) предложите молекулярную формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с оксидом серебра (I).
Дано. Найти. Формулы.
ωMe= 33,82% CxHyOz ω=Ar*X/Mr*100%
Первый способ.
1. По условию задачи сказано, что вещество реагирует с NaOH,C2H5OH и Ag2O, а также окрашивает метилоранж в розовый цвет, следовательно, искомое вещество принадлежит к классу карбоновых кислот, имеет формулу: CnH2nO2 или СnH2n+1COOH.
CnH2nO2+NаOH= CnH2nO2Na+ H2O
2. Определяем молярную массу вещества, пользуясь значением массовой долей элемента в соли.
M= 68 г/моль
Из полученной величины вычитаем Ar(Na) и Ar(О):
68г/моль – (23+2*16)=13г/моль (в веществе может содержаться только один атом С)
т.е, это муравьиная кислота НСOOH
3. Запишем структурную формулу искомого вещества
![]()
4. Запишем реакцию взаимодействия муравьиной кислоты с оксидом серебра (I).
2HCOOH+ Ag2O = 2CO2+ H2O+2Ag
Второй способ.
1. Определим молярную массу вещества, пользуясь значением массовой долей элемента в соли.
M= 68 г/моль
2. Определим молярную массу соли, используя значения относительных атомных масс элементов.
М=12n+2n+1+12+16+16+23= 14n+68г/моль
3. Составляем и решаем уравнение
14n+68=68, 14n=0, следовательно, n=0
4. Молекулярная формула определяемого вещества имеет вид: НСOOH
5. Запишем структурную формулу искомого вещества
![]()
6. Запишем реакцию взаимодействия муравьиной кислоты с оксидом серебра (I).
2HCOOH+ Ag2O = 2CO2+ H2O+2Ag
Вывод. Второй способ решения задачи возможен только в том случае, если обучающийся знает общие формулы различных классов органических веществ, владеет математическими навыками.
Задача 4.
Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Известно, что это соединение реагирует с оксидом меди(II), гидроксидом натрия.
На основании данных условий задачи:
1. Произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2. Запишите молекулярную формулу органического вещества;
3. Составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4. Напишите уравнение реакции этого вещества с оксидом меди(II).
Дано. Найти. Формулы.
ω(С)=40% CxHyOz ω=Ar*X/Mr*100%
ω(О)=53,3%
Первый способ.
В предложенном органическом веществе содержится водород. Определим его процентное содержание, пользуясь условием задачи.
ω(Н)= 100%-40%-53,3%=6,7%
Определяем количество атомов в предложенном веществе.
X(С)=40/12=3,3 y(О)=53,3/16=3,3 z=6,7/1=6,7
X: y: z=3,3:3,3:6,7=1:2:1
3. Определяем простейшую формулу вещества.
СH2O (метаналь).
4. По условию задачи искомое вещество взаимодействует с оксидом меди (2), следовательно, молекулярная формула искомого вещества: С2H4O2
5. Структурная формула вещества имеет вид:
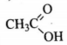
6. Записываем уравнение реакции
2 CH3COOH+CuO = (CH3COO)2Cu+ H2O
Второй способ.
1. Определяем массовую долю водорода в искомом веществе, получаем:
ω(Н)= 100%-40%-53,3%=6,7%
2. По условию задачи искомое вещество вступает в реакцию с основным оксидом, основанием, следовательно, оно может быть карбоновой кислотой.
3. Мв=29,85 n (г/моль)
4. Определим молярную массу вещества через относительные атомные массы, получим:
Мв=12n+2n+32=14 n+32 (г/моль)
5. Приравниваем значения, определяем n:
29,85 n=14 n+32, n=2
6. Составляем молекулярную формулу искомого вещества:
С2H4O2
7. Структурная формула вещества имеет вид:
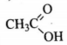
8. Записываем уравнение реакции
2 CH3COOH+CuO = (CH3COO)2Cu+ H2O
Задача 5.
При гидратации 23,80 г ацетиленового углеводорода образовалось 24,08 г органического вещества. Выход продукта составил 80 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что он имеет разветвлённый углеродный скелет. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ.
Дано. Найти. Формулы.
mCnH2n-2=23,80 г СxHyOz ω=Ar*X/Mr*100%
mCxHyOz=24,08 г m=М*n
ω (пр)=80%
Первый способ.
1. Находим массу продукта, используя исходные данные.
24,08-80% x=30,1(г)
x- 100%
2. Составляем уравнение химической реакции.
23,80г 30,1 г
CnH2n-2+ H2O = CnH2nO
1 моль 1 моль
M=14n-2г/моль M=14n+16 г/моль
m=14n-2 г m=14n+16 г
23,80(14n+16)=30,1(14n-2)
333,2n+380,8=421,4n-60,2
88, 2 n=441
n=5
3. Определяем молекулярную формулу искомого вещества.
C5H8
4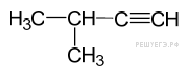 . Определяем структурную формулу соединения, учитывая, что ацетиленовый углеводород имеет разветвленное строение.
. Определяем структурную формулу соединения, учитывая, что ацетиленовый углеводород имеет разветвленное строение.
5. Записываем уравнение реакции.
+ H2O = CH3-СН-СH2-C=О
H2O = CH3-СН-СH2-C=О
\ \
CH3 H
Второй способ.
1. Составим химическое уравнение, определим по нему молярную массу вещества.
23,80г 30,1 г
CnH2n-2+ H2O = CnH2nO
m т(H2O)=30,1г-23,80г=6,3 г
n(H2O)= 0,35 моль
n(H2O)=nCnH2n-2 M CnH2n-2== 69 г/моль
2. Определяем молярную массу искомого вещества через относительные атомные массы элементов, учитывая, что по условию задачи нам предлагается алкин.
М CnH2n-2=14n-2г/моль
14n-2=68, n=5
3. Определяем молекулярную формулу искомого вещества.
C5H8
4![]() . Определяем структурную формулу соединения, учитывая, что ацетиленовый углеводород имеет разветвленное строение.
. Определяем структурную формулу соединения, учитывая, что ацетиленовый углеводород имеет разветвленное строение.
5. Записываем уравнение реакции.
+ H2O = CH3-СН-СH2-C=О
H2O = CH3-СН-СH2-C=О
\ \
CH3 H
Вывод. Второй способ решения задачи возможен только в том случае, если обучающийся знает общие формулы классов органических веществ, их химические свойства.
Задача 6.
Некоторый углеводород содержит 12,19% водорода по массе. Молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием бурого осадка. На основании этих данных:
1) установите простейшую формулу углеводорода,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
Дано. Найти. Формулы.
ω(Н)=12,19% СxHy ω=Ar*X/Mr*100%
Первый способ.
1. В задаче сказано об углеводороде, поэтому определяем процентное содержание углерода в искомом соединении.
ω(С)= 100%-12,19%=87,81%
2. Определяем количество атомов углерода и водорода, пользуясь формулой массовой доли элемента в веществе.
X:Y= ω(С)/ Ar(С): ω(Н)/ Ar(Н)=87,81/12:12,19:1=7,3:12,19=6:10
3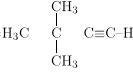 . Молекулярная формула С6H10
. Молекулярная формула С6H10
4. Структурная формула искомого вещества:
5. Записываем уравнение реакции.
![]()
Второй способ.
1. По условию задачи углеводород вступает в реакцию замещения с аммиачным раствором оксида серебра с образованием бурого осадка. На основании этих данных можно предположить, что оно относится к классу алкинов, причем тройная связь располагается в первом положении.
2. Определяем молярную массу алкина, зная общую формулу данного класса углеводородов:
Mв=14n-2 (г/моль)
3. Определяем молярную массу через процентное содержание водорода в соединении, получаем
Мв =0,1219
4. Решаем уравнение.
0,1219=14n-2, n=6
5 . Молекулярная формула вещества С6H10
. Молекулярная формула вещества С6H10
4. Структурная формула искомого вещества:
5. Записываем уравнение реакции.
![]()
Вывод. Второй способ решения задачи возможен только в том случае, если обучающийся знает общие формулы классов органических веществ, их химические свойства.
Алгоритм решения задач на вывод формул органических соединений.
Было решено 20 задач на вывод формул органических соединений (из-за ограничения по объему, в работу включено только шесть задач №34 из ЕГЭ по химии). Самыми распространенными являются задачи на определение молекулярной формулы вещества по известным продуктам сгорания, поэтому алгоритм мы предложим именно на примере такого вида задач.
1. Определяем молярную массу исходного вещества через известную относительную плотность паров по газу (при ее наличии в условии задачи).
1. Рассчитываем количество (в молях) продуктов реакции через молярный объем для газа и через плотность и массу для жидкости.
2. Определяем количество атомов углерода, водорода (иных атомов) в продуктах реакции, их массу.
3. Суммируем массу атомов, сравниваем полученный результат с исходной массой органического соединения.
4. В случае если исходная масса больше полученной величины, в молекуле присутствует кислород.
5. Определяем массу кислорода, вычитая из исходной массы органического вещества полученную сумму атомов водорода и углерода (иных атомов).
6. Находим количество атомов кислорода по формуле (в молях).
7. Находим отношение количеств атомов углерода, водорода, кислорода. Получаем формулу вещества.
8. Составляем молекулярную формулу вещества, определяем его молярную массу.
9. При ее отличии от полученной в первом действии величины, увеличиваем количество каждого атома в определенное число раз.
10. Составляем молекулярную формулу искомого вещества.
11. Составляем структурную формулу вещества.
12. Записываем уравнение химической реакции, используя структурные формулы органических соединений.
Последовательность подготовки к ЕГЭ по химии.
Для того чтобы подготовиться к выпускному экзамену по химии, необходимо разработать определенный алгоритм действий. Предлагаем следующий вариант действий.
Повторение материала 8-9 класса по неорганической химии (сентябрь-февраль).
Повторение материала 10 класса по органической химии (февраль – март).
Посещение элективного курса по химии (сентябрь-май).
Использование интернет-технологий, работа с образовательными сайтами: mioo.ru, ege.edu.ru, rustest.ru, ed.gov.ru.
Работа с демонстрационными версиями ЕГЭ, кодификаторами и спецификацией тестов по химии.
Решение расчетных задач (сентябрь-май).
Написание диагностических контрольных работ в формате ЕГЭ в системе СтатГрад (апрель, май) и анализ ошибок.
4. Заключение.
Успех на ЕГЭ зависит именно от организационной подготовки, от информированности выпускников о технологии проведения экзамена, его структуре.
Особое значение имеет самостоятельная подготовка, решение наиболее сложных заданий, разбор их с педагогами.
Рекомендации по проблеме исследования.
1. В проведении пробных экзаменов помогают КИМы тренировочных и диагностических работ Московского института открытого образования, размещаемых в системе дистанционной подготовки Статград http://statgrad.mioo.ru.
2. Пассивно заслушанные, заученные знания, не гарантируют успешной сдачи государственного экзамена по химии.
3. Результат можно получить только в том случае, если происходит систематическое самообразование, дополнительная подготовка вне школьного курса.
4. Для самоподготовки обучающимся рекомендуем он-лайн тестирование в системе интернет-ресурсов.
5. Эксперимент является источником приобретения знаний, позволяет предупреждать ошибки в расчетных заданиях. С его помощью можно проверить истинность выдвинутой гипотезы, понять правильность проведения вычислений.
6. При самостоятельном проведении экспериментов, можно на практике познакомиться с качественными реакциями, использовать приобретенные знания и навыки при решении задач повышенной сложности (на вывод формул органических соединений).
7. Успешность выполнения расчетных задач повышенной сложности зависит от осознания алгоритма действий.
8. Только при сформированности общеучебных универсальных навыков: планирования, организации, контроля, регулирования, анализа собственной деятельности, можно рассчитывать на получение высоких результатов на ЕГЭ по химии.
9. Существует несколько способов решения расчетных задач на вывод формул органических веществ. При выборе последовательности действий, важно учитывать уровень знаний.
10. При качественном усвоении химических свойств органических веществ, можно начитать рассуждения с составления обей формулы вещества, учитывая данные задачи.
11. При недостаточном владении теоретическим материалом, можно использовать стандартную последовательность действий.
Библиографический список.
Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. - М.: Клив, 2014. - 420 с.
Гузей Л. С., Кузнецов В. Н. Новый справочник по химии. – М.: Большая Медведица, 1998. - 265 с.
ЕГЭ. Химия. Тематические тренировочные задания. Уровень А, В, С/Р. А. Лидин. – М.: Издательство «Экзамен», 2015. – 141 с.
ЕГЭ. Химия 2017 /авт.-сост. А. А. Каверина, Д. Ю. Добротин, А. С. Корощенко, М. Г. Снастина. – М.:АСТ: Астрель, 2017. – 139, [5] с.
Пилипенко А. Т.. Пятницкий И. В. Аналитическая химия: В двух кн. 1 - М.: Химия, 1990. 480 с.
Интернет ресурсы:
https://aocoko.ru/
http://www.moeobrazovanie.ru
http://www.master-multimedia.ru
http://onlinetestpad.com
https://chem-ege.sdamgia.ru/
6. Приложения.
6.1 Результаты выполнения заданий уровня сложности по разделам предмета и содержательным блокам https://aocoko.ru/
Таблица 10
| Обозначение задания в работе | Проверяемые элементы содержания
| Проверяемые умения | Уровень сложности задания | Средний процент выполнения по региону (количество получивших максимальный балл) |
| 30 | Реакции окислительно-восстановительные. Виды коррозии металлов. Способы предупреждения коррозии | Понимать, что практическое применение веществ обусловлено их составом, строением и свойствами Иметь представление о роли и значении данного вещества в практике | В | 38,5 |
| 31 | Реакции, подтверждающие взаимосвязь различных классов неорганических веществ | Уметь определять принадлежность веществ к различным классам неорганических и органических веществ
| В | 10,6 |
| 32 | Реакции, подтверждающие взаимосвязь различных классов органических веществ | Уметь определять принадлежность веществ к различным классам неорганических и органических веществ Планировать эксперимент по получению и распознаванию веществ с учетом знаний о правилах работы с веществами | В | 22,4 |
| 33 | Расчеты массы, объема, количества вещества, если одно из исходных веществ дано в избытке, имеет примеси, дано в растворе с известной массовой долей растворенного вещества | Планировать и проводить вычисления по химическим уравнениям | В | 1,9 |
| 34 | Нахождение молекулярной формулы органического вещества | Планировать и проводить вычисления по химическим формулам | В | 8,3 |
6.2 Приложение 2. Результаты выполнения последнего блока учащимися Архангельской области заданий в 2017 году.
| Раздел | Содержательные блоки раздела | № заданий | Уровень сложности задания | Процент выполнения задания | |||||||
| 2016 | 2017 | ||||||||||
|
|
|
| 2016 | 2017 | |||||||
| 4.3 Расчеты по химическим формулам и уравнениям реакций | 27 | Б | 66 | 59 | |||||||
| 28 | Б | 69,5 | 65,5 | ||||||||
| 29 | Б | 63 | 48 | ||||||||
|
|
| 2016 | 2017 | ||||||||
|
|
| 1 балл | 2 балла | 3 балла | 4 балла | 1 балл | 2 балла | 3 балла | 4 балла | ||
| 33 | В | 9 | 3 | 2 | 3 | 10 | 9 | 6 | 2 | ||
| 34 | В | 9 | 23 | 1 | 11 | 20 | 8 | 6 | 8 | ||
19

 Получите свидетельство
Получите свидетельство Вход
Вход













 Методика решения расчетных задач на вывод формул органических и неорганических вещества. (226 KB)
Методика решения расчетных задач на вывод формул органических и неорганических вещества. (226 KB)
 0
0 1142
1142 39
39 Нравится
0
Нравится
0


